Wirkstoffe: Prulifloxacin
KERAFLOX 600 mg Filmtabletten
Indikationen Warum wird Keraflox verwendet? Wofür ist das?
Keraflox gehört zu einer Gruppe von Antibiotika, die Fluorchinolone genannt werden. Keraflox ist indiziert zur Behandlung von Infektionen, die durch Bakterien verursacht werden, die gegenüber Prulifloxacin empfindlich sind, unter folgenden Bedingungen:
- Infektionen der unteren Harnwege (einfache Blasenentzündung).
- Infektionen der unteren Harnwege in Verbindung mit anderen medizinischen Harnwegskomplikationen (komplizierte Blasenentzündung).
- Plötzliche Verschlimmerung einer chronischen Bronchitis (Aufflammen einer chronischen Bronchitis).
- Akute bakterielle Rhinosinusitis.
Der Arzt wird die infektiöse Rhinosinusitis gemäß den nationalen und lokalen Richtlinien zur Behandlung von Infektionen diagnostizieren und behandeln. Keraflox kann zur Behandlung einer infektiösen Rhinosinusitis angewendet werden, deren Symptome weniger als 4 Wochen andauern, und in Fällen, in denen normale Antibiotika nicht angewendet werden können oder nicht gewirkt haben.
Kontraindikationen Wann Keraflox nicht verwendet werden sollte
Keraflox darf nicht eingenommen werden:
- wenn Sie allergisch gegen Prulifloxacin, andere Fluorchinolone oder einen der sonstigen Bestandteile dieses Arzneimittels sind.
- Wenn Sie unter 18 Jahre alt sind.
- wenn Sie nach der Anwendung anderer Chinolone bereits an Sehnenproblemen gelitten haben, wie z. B. Sehnenentzündungen (Tendinitis).
- Wenn Sie schwanger sind oder stillen.
Vorsichtsmaßnahmen für die Anwendung Was sollten Sie vor der Einnahme von Keraflox® beachten?
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie Keraflox einnehmen:
- wenn Sie an Epilepsie oder einer Krankheit leiden, die das Auftreten von Krämpfen (Krämpfen) erhöht
- Da bei anderen Antibiotika der Fluorchinolon-Klasse Herzrhythmusstörungen (im EKG, einer Aufzeichnung der elektrischen Aktivität des Herzens) beobachtet wurden, informieren Sie bitte Ihren Arzt, wenn Sie in der Vorgeschichte Herzrhythmusstörungen haben. Keraflox hat ein sehr geringes Potenzial zur Induktion einer QT-Intervall-Verlängerung
- wenn Sie Arzneimittel zur Kontrolle des Herzrhythmus oder Arzneimittel einnehmen, die kardiale Wirkungen haben können, wie Antidepressiva oder andere Antibiotika (siehe „Bei Einnahme von Keraflox mit anderen Arzneimitteln“)
- Wenn Sie an einem Aktivitätsmangel der Glucose-6-Phosphat-Dehydrogenase (G6PD) leiden, da dieses Medikament möglicherweise nicht geeignet ist
- wenn Sie Leber- oder Nierenprobleme haben
- wenn Sie an einer Laktoseintoleranz leiden, da dieses Arzneimittel Laktose enthält
- Wenn bei Ihnen nach der Anwendung von Antibiotika schwere Durchfälle aufgetreten sind: Informieren Sie sofort Ihren Arzt und beenden Sie die Einnahme von Keraflox, wenn Sie während der Einnahme von Keraflox einen schweren Anfall von flüssigem Durchfall bekommen.
Dieses Arzneimittel kann manchmal Muskel- oder Sehnenprobleme verursachen (siehe „Mögliche Nebenwirkungen“).
Informieren Sie sofort Ihren Arzt und beenden Sie die Einnahme von Keraflox, wenn bei Ihnen während der Einnahme von Keraflox Muskelschmerzen, Muskelschwäche, dunkler Urin oder Symptome einer Sehnenentzündung wie Gelenkschwellung oder Schmerzen auftreten.
Da dieses Arzneimittel die Bildung von winzigen Kristallen im Urin verursachen kann, ist es erforderlich, während der Behandlung mit Keraflox eine hohe Wasseraufnahme aufrechtzuerhalten, um eine Konzentration im Urin zu verhindern.
Übermäßige Sonneneinstrahlung, UV-Lampen oder Solarien sollten während der Behandlung mit diesem Arzneimittel vermieden werden, da die Haut empfindlicher als sonst sein kann. Brechen Sie die Einnahme dieses Arzneimittels ab und informieren Sie sofort Ihren Arzt, wenn Sie schwere Sonnenreaktionen wie Sonnenbrand oder Häutung.
Wenn Ihr Sehvermögen nachlässt oder Ihre Augen anderweitig beeinträchtigt sind, suchen Sie sofort einen Augenarzt auf.
Wechselwirkungen Welche Medikamente oder Lebensmittel können die Wirkung von Keraflox® beeinflussen?
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen, kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen andere Arzneimittel einzunehmen.
Einige Medikamente beeinflussen die Wirkung von Keraflox. Keraflox sollte 2 Stunden vor oder mindestens 4 Stunden nach der Einnahme dieser Arzneimittel eingenommen werden.
- Arzneimittel gegen Verdauungsstörungen, Sodbrennen oder Geschwüre, wie Cimetidin oder Antazida, die Aluminium oder Magnesium enthalten
- Arzneimittel, die Eisen oder Kalzium enthalten
Keraflox wiederum kann die Wirkung anderer Arzneimittel beeinflussen und das Risiko von Nebenwirkungen erhöhen.
Informieren Sie Ihren Arzt, wenn Sie Folgendes einnehmen:
- Medikamente gegen Diabetes
- Arzneimittel zur Kontrolle der Herzfrequenz wie Amiodaron, Chinidin oder Procainamid
- Andere Antibiotika wie Erythromycin, Clarithromycin oder Azithromycin
- Arzneimittel gegen Depressionen wie Amitriptylin, Clomipramin oder Imipramin
- Probenecid zur Senkung der Harnsäure im Blut
- Fenbufen zur Linderung von Arthritis-Schmerzen
- Theophyllin bei Asthma oder Atembeschwerden
- Arzneimittel zur Verhinderung der Blutgerinnung wie Warfarin
- Nicardipin zur Behandlung von Angina (Brustschmerzen) oder Bluthochdruck
- Steroide wie Prednisolon zur Behandlung von allergischen Zuständen oder Entzündungen
Einnahme von Keraflox zusammen mit Nahrungsmitteln und Getränken
Nahrung und Milch können die Wirkung von Keraflox beeinflussen. Keraflox sollte zwischen den Mahlzeiten auf nüchternen Magen eingenommen werden und darf nicht mit Milch oder Milchderivaten eingenommen werden.
Warnungen Es ist wichtig zu wissen, dass:
Schwangerschaft, Stillzeit und Fruchtbarkeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Keraflox kann Schwindel und Verwirrung verursachen. Wenn Sie eines dieser Symptome bemerken, dürfen Sie kein Fahrzeug führen und keine gefährlichen Werkzeuge oder Maschinen bedienen.
Keraflox enthält Lactose
Keraflox enthält Lactose, eine Zuckerart. Bitte nehmen Sie dieses Arzneimittel erst nach Rücksprache mit Ihrem Arzt ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Dosis, Methode und Zeitpunkt der Anwendung Wie ist Keraflox anzuwenden: Dosierung
Nehmen Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt ein. Fragen Sie im Zweifelsfall Ihren Arzt oder Apotheker.
Keraflox-Tabletten sollten im Ganzen mit Wasser und zwischen den Mahlzeiten auf nüchternen Magen geschluckt werden und dürfen nicht mit Milch oder Milchderivaten eingenommen werden.
Keraflox ist nur für Erwachsene geeignet. Die empfohlene Dosis beträgt:
- Bei einfacher Blasenentzündung: einmal eine 600-mg-Tablette.
- Bei komplizierter Blasenentzündung: eine 600-mg-Tablette einmal täglich für bis zu 10 Behandlungstage.
- Zur Verschlimmerung einer chronischen Bronchitis: 1-mal täglich eine 600-mg-Tablette für eine maximale Behandlungsdauer von 10 Tagen.
- Bei akuter bakterieller Rhinosinusitis: eine 600-mg-Tablette einmal täglich für bis zu 10 Behandlungstage.
Während der Einnahme von Keraflox ist es notwendig, viel Wasser zu trinken.
Die Dauer der Behandlung hängt von der Schwere der Infektion und dem Ansprechen des Patienten auf die Behandlung ab.Sie sollten immer die volle Einnahme der Ihnen verschriebenen Tabletten einnehmen, auch wenn Sie sich besser fühlen und Ihre Symptome verschwinden.
Wenn Sie die Einnahme von Keraflox® vergessen haben
Wenn Sie die Einnahme einer Dosis vergessen haben, nehmen Sie diese ein, sobald Sie sich daran erinnern, es sei denn, es ist bereits Zeit für Ihre nächste Dosis. Nehmen Sie nicht die doppelte Dosis ein, wenn Sie die vorherige Einnahme vergessen haben.
Wenn Sie die Einnahme von Keraflox® abbrechen
Wenn Sie die Einnahme dieses Arzneimittels zu früh beenden, kann die Infektion erneut auftreten. Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Überdosierung Was ist zu tun, wenn Sie zu viel Keraflox® eingenommen haben?
Im Falle einer Überdosierung wenden Sie sich sofort an Ihren Arzt oder begeben Sie sich in die nächstgelegene Notaufnahme eines Krankenhauses. Ihr Krankenhausarzt muss möglicherweise eine Magenentleerung durchführen. Tragen Sie die Packung mit der Packungsbeilage immer bei sich, unabhängig davon, ob sich noch Keraflox in der Packung befindet oder nicht.
Nebenwirkungen Was sind die Nebenwirkungen von Keraflox®
Wie alle Arzneimittel kann Keraflox Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Informieren Sie sofort Ihren Arzt und beenden Sie die Einnahme von Keraflox, wenn Sie nach der Einnahme dieses Arzneimittels eines der folgenden Symptome bemerken.
Obwohl sehr selten, können diese Symptome schwerwiegend sein.
- Plötzliches Keuchen, Atembeschwerden, Anschwellen der Augenlider, des Gesichts oder der Lippen, Hautausschlag oder Juckreiz (insbesondere am ganzen Körper).
- Schwerer Hautausschlag mit Blasenbildung auf der Haut und manchmal in Mund und Zunge. Dies können Symptome einer Erkrankung sein, die als Stevens-Johnson-Syndrom bekannt ist.
- Schwere Sonnenreaktionen wie Sonnenbrand oder Peeling.
- Entzündungssymptome der Sehnen wie Schwellung oder Schmerzen der betroffenen Extremität Am häufigsten ist die Achillessehne betroffen und kann zu ihrer Ruptur führen Die von der Entzündung betroffene Stelle sollte bis zur Untersuchung durch den Arzt ruhig gehalten werden.
- Muskelschmerzen, Muskelschwäche oder dunkler Urin.
- Schwere Anfälle von flüssigem Durchfall, der teerschwarz oder blutig ist.
- Niedriger Blutzuckerspiegel, der Zittern und Reizbarkeit verursachen kann.
- Taubheit, Verlust des Schmerzempfindens.
- Rötung und Abschälung der Haut (Dermatitis).
- Bildung von winzigen Kristallen im Urin ohne Symptome.
Andere mögliche Nebenwirkungen sind:
Häufige Nebenwirkungen (bei weniger als einem von 10 Patienten):
- Bauchschmerzen
Gelegentliche Nebenwirkungen (bei weniger als einem von 100 Patienten):
- Nicht gut fühlen
- Durchfall, Erbrechen, Magenentzündung
- Kopfschmerzen, Schwindel
- Juckreiz oder Hautausschlag
- Appetitverlust
Seltene Nebenwirkungen (bei weniger als einem von 1000 Patienten):
- Fieber, Hitzewallungen
- Geschmacksveränderungen
- Schlafstörungen, Verwirrung oder Schläfrigkeit
- Hörminderung
- Rötung und Reizung der Augen
- Magenschmerzen, Blähungen, Blähungen, Verdauungsstörungen oder Sodbrennen, abnormaler Stuhlgang
- Reizung der Lippen, Zunge oder des Mundes oder Pilzinfektion (orale Moniliasis)
- Muskelkrämpfe, Muskelschäden
- Trockene und juckende Haut (Ekzem), Überempfindlichkeit gegen Licht oder rote Flecken auf der Haut (Nesselsucht)
- Erhöhte Leberenzyme in Bluttests sichtbar
- Unruhe fühlen
- Mundgeschwür
- Gelenkschmerzen breiten sich über den ganzen Körper aus
- Erhöhte Albumin (Protein) im Blut
- Erhöhte Kalziumwerte im Blut
- Erhöhung der Anzahl der weißen Blutkörperchen
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker, einschließlich aller möglichen Nebenwirkungen, die nicht in dieser Packungsbeilage aufgeführt sind. Sie können Nebenwirkungen auch direkt über das nationale Meldesystem unter www.agenziafarmaco.it/it/responsabili melden.Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
Ablauf und Aufbewahrung
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Nicht über 30 °C lagern.
Im Originalbehälter aufbewahren.
Wenden Sie Keraflox nicht nach dem auf der Packung angegebenen Verfallsdatum an. Das Ablaufdatum bezieht sich auf den letzten Tag des Monats.
Werfen Sie Arzneimittel nicht in das Abwasser oder den Hausmüll. Fragen Sie Ihren Apotheker, wie Sie Arzneimittel, die Sie nicht mehr verwenden, entsorgen. Dies trägt zum Schutz der Umwelt bei.
Andere Informationen
Was Keraflox enthält
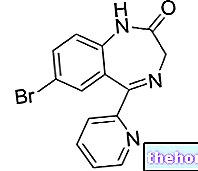
Der Wirkstoff ist Prulifloxacin. Jede Filmtablette enthält 600 mg Prulifloxacin.
Die sonstigen Bestandteile sind: Lactose-Monohydrat; mikrokristalline Cellulose; Croscarmellose-Natrium; Povidon; wasserfreies kolloidales Siliciumdioxid; Magnesiumstearat; Hypromellose; Propylenglykol; Titandioxid (E171); Talk; Eisenoxid (E 172).
Beschreibung wie Keraflox aussieht und Inhalt der Packung
Keraflox Tabletten sind gelb, länglich, filmbeschichtet und in Kartonpackungen mit einer Blisterpackung mit 1, 2, 5 Tabletten oder zwei Blisterpackungen mit 5 Tabletten erhältlich.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Quelle Packungsbeilage: AIFA (Italienische Arzneimittelbehörde). Im Januar 2016 veröffentlichter Inhalt. Die vorliegenden Informationen können nicht aktuell sein.
Um Zugriff auf die aktuellste Version zu erhalten, ist es ratsam, auf die Website der AIFA (Italienische Arzneimittelbehörde) zuzugreifen. Haftungsausschluss und nützliche Informationen.
01.0 BEZEICHNUNG DES ARZNEIMITTELS
KERAFLOX 600 MG TABLETTEN MIT FILM . BESCHICHTET
02.0 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Filmtablette enthält 600 mg Prulifloxacin®
Sonstige Bestandteile mit bekannter Wirkung: Jede Filmtablette enthält 76 mg Lactose
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
03.0 DARREICHUNGSFORM
Filmtabletten.
Längliche, gelbe Filmtabletten.
04.0 KLINISCHE INFORMATIONEN
04.1 Anwendungsgebiete
Keraflox ist indiziert zur Behandlung von Infektionen, die durch anfällige Stämme verursacht werden, bei den folgenden Pathologien:
• akute unkomplizierte Infektionen der unteren Harnwege (einfache Zystitis);
• komplizierte Infektionen der unteren Harnwege;
• Verschlimmerung einer chronischen Bronchitis;
• akute bakterielle Rhinosinusitis.
Eine akute bakterielle Sinusitis muss gemäß den nationalen oder lokalen Richtlinien zur Behandlung von Atemwegsinfektionen adäquat diagnostiziert werden. Zur Behandlung einer bakteriellen Rhinosinusitis sollte Keraflox nur bei Patienten angewendet werden, bei denen die Dauer der Symptome weniger als 4 Wochen beträgt und wenn die Anwendung anderer Antibiotika, die üblicherweise zur Erstbehandlung einer solchen Infektion empfohlen werden, als ungeeignet erachtet wird, oder im Fall von die sich als unwirksam erwiesen haben.
Bei der Behandlung von Patienten mit Infektionskrankheiten müssen lokale Besonderheiten hinsichtlich der Antibiotikaempfindlichkeit berücksichtigt werden.
04.2 Dosierung und Art der Anwendung
Dosierung
Beschränkt auf Erwachsene ist die indikative Dosierung wie folgt:
• Patienten mit unkomplizierten akuten Infektionen der unteren Harnwege (einfache Zystitis): nur eine 600-mg-Tablette ist ausreichend;
• Patienten mit komplizierten Infektionen der unteren Harnwege: eine 600-mg-Tablette einmal täglich für bis zu 10 Behandlungstage.
• Patienten mit Bronchitis-Exazerbation: eine 600-mg-Tablette einmal täglich für eine maximale Behandlungsdauer von 10 Tagen.
• Patienten mit akuter bakterieller Rhinosinusitis: eine 600-mg-Tablette einmal täglich für bis zu 10 Behandlungstage.
Bei komplizierten Infektionen der unteren Harnwege und akuter Exazerbation einer chronischen Bronchitis hängt die Behandlungsdauer von der Schwere der Erkrankung und dem klinischen Verlauf des Patienten ab und muss in jedem Fall mindestens 48-72 Stunden nach der Remission / dem Verschwinden andauern von Symptomen.
Aufgrund des Fehlens spezifischer Studien ist es nicht möglich, die Dosierung bei Patienten mit Niereninsuffizienz (Patienten mit Leberinsuffizienz der Kreatinin-Clearance) zu bestimmen. Daher ist bei diesen Patienten die Überwachung der Plasmaspiegel des Arzneimittels die zuverlässigste Methode zur Dosisanpassung.
Art der Verabreichung
Keraflox-Tabletten sollten im Ganzen mit Wasser geschluckt und entsprechend der Nahrungsaufnahme eingenommen werden (siehe Abschnitt 4.5).
04.3 Kontraindikationen
- Überempfindlichkeit gegen Prulifloxacin, andere Chinolon-Antibiotika oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Kinder vor der Pubertät oder Jungen unter 18 Jahren mit unvollständiger Skelettentwicklung.
- Patienten mit Sehnenerkrankungen in der Vorgeschichte im Zusammenhang mit der Verabreichung von Chinolonen.
- Schwangerschaft und Stillzeit (siehe Abschnitt 4.6).
04.4 Besondere Warnhinweise und geeignete Vorsichtsmaßnahmen für die Anwendung
Wie andere Chinolone sollte Keraflox bei Patienten mit ZNS-Erkrankungen, die zu Krampfanfällen prädisponieren oder die Krampfschwelle herabsetzen können, mit Vorsicht angewendet werden.
Einige der anderen Substanzen der Fluorchinolon-Klasse wurden mit Fällen von QT-Intervall-Verlängerung in Verbindung gebracht Prulifloxacin hat ein sehr geringes Potenzial zur Induktion einer QT-Intervall-Verlängerung.
Wie bei der Verabreichung anderer Arzneimittel der gleichen therapeutischen Klasse tritt eine Tendinitis selten auf. Am häufigsten ist die Achillessehne betroffen und kann zu einem Bruch führen. Das Risiko von Sehnenentzündungen und Sehnenrupturen ist bei älteren Patienten und bei Patienten, die Kortikosteroide erhalten, erhöht.
Die Patienten sollten angewiesen werden, bei Anzeichen einer Sehnenentzündung, Myalgie, Schmerzen oder Gelenkentzündung die Behandlung abzubrechen und die betroffene Gliedmaße oder die betroffenen Gliedmaßen in Ruhe zu lassen, bis die Diagnose einer Sehnenentzündung ausgeschlossen ist.
Sonneneinstrahlung oder ultraviolette Strahlen können bei Patienten, die mit Prulifloxacin oder anderen Chinolonen behandelt werden, Phototoxizität verursachen. Übermäßige Sonnen- oder ultraviolette Strahlen sollten während der Behandlung mit Keraflox vermieden werden; Im Falle einer Phototoxizität sollte die Behandlung abgebrochen werden.
Patienten mit latenten oder bekannten Defekten der Glucose-6-Phosphat-Dehydrogenase-Aktivität neigen bei Behandlung mit Chinolon-Antibiotika zu hämolytischen Reaktionen, weshalb Keraflox mit Vorsicht angewendet werden sollte.
Wie für andere Chinolone berichtet, können selten Rhabdomyolyse-Phänomene auftreten, die durch Myalgie, Asthenie, erhöhte Plasma-CPK- und Myoglobin-Werte und schnelle Verschlechterung der Nierenfunktion gekennzeichnet sind. In diesen Fällen sollte der Patient sorgfältig überwacht und geeignete Korrekturmaßnahmen ergriffen werden, einschließlich einer möglichen Beendigung der Behandlung.
Die Anwendung von Chinolonen ist manchmal mit dem Auftreten von Kristallurie verbunden; Patienten, die mit dieser Klasse von Produkten behandelt werden, müssen einen angemessenen Wasserhaushalt aufrechterhalten, um eine Konzentration im Urin zu vermeiden.
Die Verträglichkeit und Wirksamkeit von Keraflox bei Patienten mit Leberinsuffizienz wurde nicht untersucht.
Bei der Verschreibung einer Antibiotikatherapie sollten lokale und/oder nationale Richtlinien zum angemessenen Einsatz von Antibiotika berücksichtigt werden.
Das Arzneimittel enthält Lactose; Daher sollten Patienten mit der seltenen hereditären Galactose-Intoleranz, Lapp-Lactase-Mangel oder Glucose-Galactose-Malabsorption dieses Arzneimittel nicht einnehmen.
Sehstörungen
Bei Sehstörungen oder auftretenden Auswirkungen auf die Augen sollte sofort ein Augenarzt aufgesucht werden.
Krankheit im Zusammenhang mit Clostridium difficile
Wenn während oder nach der Prulifloxacin-Therapie (auch mehrere Wochen nach der Behandlung) Durchfall auftritt, insbesondere wenn er schwerwiegend, anhaltend und/oder blutig ist, kann dies die Folge einer Erkrankung sein, die mit Clostridium difficile (Clostridium difficile-assoziierte Krankheit, CDAD). Der Schweregrad von CDAD kann von leicht bis lebensbedrohlich reichen; die schwerste Form ist die pseudomembranöse Kolitis (siehe Abschnitt 4.8). Daher ist es wichtig, diese Diagnose bei Patienten zu erwägen, die während oder nach der Behandlung mit Prulifloxacin einen schweren Durchfall entwickeln. Bei Verdacht oder Bestätigung einer CDAD sollte die laufende Behandlung mit Antibiotika, einschließlich Prulifloxacin, sofort abgebrochen und umgehend eine geeignete Therapie eingeleitet werden. Bei diesem klinischen Zustand sind antiperistaltische Arzneimittel kontraindiziert. Um das Übertragungsrisiko zu reduzieren, müssen zudem angemessene Infektionsschutzmaßnahmen ergriffen werden.
04.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Behandlung mit Cimetidin, Al- und Mg-haltigen Antazida oder eisen- und kalziumhaltigen Präparaten verringert die Resorption von Keraflox, daher sollte Keraflox 2 Stunden vor oder mindestens 4 Stunden nach Einnahme dieser Präparate verabreicht werden.
Die gleichzeitige Einnahme von Prulifloxacin und Milch bewirkt eine Abnahme der Fläche unter der Konzentrations-Zeit-Kurve (AUC) und verringert die Ausscheidung von Prulifloxacin über den Urin, während die Nahrungsaufnahme verlangsamt und Spitzenwerte reduziert.
Die Ausscheidung von Prulifloxacin über den Urin nimmt ab, wenn es zusammen mit Probenecid gegeben wird.Die gleichzeitige Anwendung von Fenbufen mit einigen Chinolonen kann zu einem erhöhten Risiko für Krampfanfälle führen, daher sollte die Anwendung von Keraflox und Fenbufen sorgfältig erwogen werden.
Chinolone können bei Diabetikern, die hypoglykämische Medikamente einnehmen, eine Hypoglykämie verursachen. Die gleichzeitige Anwendung von Keraflox und Theophyllin kann zu einer leichten Abnahme der Theophyllin-Clearance führen, von der keine klinische Relevanz erwartet wird. Wie bei anderen Chinolonen ist jedoch eine Überwachung der Theophyllin-Plasmaspiegel bei Patienten mit Stoffwechselstörungen oder Risikofaktoren ratsam.
Chinolone können die Wirkung von oralen Antikoagulanzien wie Warfarin und seinen Derivaten verstärken; Wenn diese Produkte zusammen mit Keraflox angewendet werden, wird eine engmaschige Überwachung mit einem Prothrombintest oder anderen zuverlässigen Gerinnungstests empfohlen.
Präklinische Daten haben gezeigt, dass Nicardipin die Phototoxizität von Prulifloxacin verstärken kann. Während der klinischen Entwicklung von Keraflox wurden nach gleichzeitiger Anwendung mit anderen Arzneimitteln, die üblicherweise bei der Behandlung von Patienten mit den in Abschnitt 4.1 aufgeführten Erkrankungen angewendet werden, keine klinisch signifikanten Wechselwirkungen beobachtet.
04.6 Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine klinischen Daten zur Anwendung von Prulifloxacin während einer etablierten Schwangerschaft vor. Tierexperimentelle Studien zeigten keine Teratogenität. Andere reproduktionstoxische Wirkungen wurden nur bei der Maternaltoxizität festgestellt (siehe Abschnitt 5.3).
Fütterungszeit
Bei Ratten wurde gezeigt, dass Prulifloxacin die Plazentaschranke passiert und in großen Mengen in die Muttermilch übergeht. Wie andere Chinolone hat Prulifloxacin bei Jungtieren Arthropathien verursacht, weshalb seine Anwendung während der Trächtigkeit und Laktation kontraindiziert ist.
04.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Chinolone können Schwindel und Verwirrung verursachen, daher sollte der Patient wissen, wie er auf die Behandlung anspricht, bevor er ein Fahrzeug führt, Maschinen bedient oder Aktivitäten ausführt, die Aufmerksamkeit und Koordination erfordern.
04.8 Nebenwirkungen
Die unten aufgeführten Nebenwirkungen sind auf mit Keraflox durchgeführte klinische Studien zurückzuführen. Die meisten unerwünschten Ereignisse waren von leichter oder mäßiger Intensität.
Die folgenden MedDRA-Häufigkeitswerte wurden verwendet: sehr häufig (≥ 1/10), häufig (≥ 1/100,
Die folgenden Nebenwirkungen wurden ebenfalls berichtet (Häufigkeit nicht bekannt): anaphylaktische/anaphylaktoide Reaktion einschließlich Angioödem, Dyspnoe, Steven-Johnson-Syndrom, Hypoglykämie, Hypästhesie, Parästhesie, Tremor, Arzneimitteldermatitis, Rhabdomyolyse, Phototoxizität, Tachykardie, pseudomembranöse Kolitis.
Die Behandlung mit Keraflox kann mit einer asymptomatischen Kristallurie ohne Veränderungen des Kreatininspiegels, mit Veränderungen der Leberfunktionsparameter und Eosinophilie einhergehen. In den beobachteten Fällen waren diese Veränderungen asymptomatisch und vorübergehend.
Während der Behandlung mit Keraflox kann das Auftreten von Nebenwirkungen und Laboranomalien, die oben nicht erwähnt, aber für die anderen Chinolone berichtet wurden, nicht ausgeschlossen werden.
Pharmakovigilanz-Daten für Prulifloxacin und nach Markteinführung zeigen sporadische Berichte über Tendinopathie (siehe 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Meldung von vermuteten Nebenwirkungen
Die Meldung von vermuteten Nebenwirkungen, die nach der Zulassung des Arzneimittels auftreten, ist wichtig, da sie eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels ermöglicht. Angehörige von Gesundheitsberufen werden gebeten, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem zu melden. "Adresse www. agenziafarmaco.gov.it/it/responsabili.
04.9 Überdosierung
Die orale Verabreichung von Einzeldosen bis zu 5000 mg/kg bei Mäusen, Ratten und Hunden (männlich und weiblich) hatte keine letalen Wirkungen.
Es liegen keine Informationen zur Überdosierung beim Menschen vor; Keraflox wurde bei gesunden Freiwilligen mit insgesamt guter Verträglichkeit 12 Tage lang bis zu einer Dosis von 1200 mg/Tag verabreicht.
Bei akuter Überdosierung sollte der Magen durch Erbrechen oder Magenspülung entleert, der Patient sorgfältig beobachtet und symptomatisch behandelt werden.
05.0 PHARMAKOLOGISCHE EIGENSCHAFTEN
05.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Fluorchinolone.
ATC-Code: J01MA17.
Prulifloxacin ist ein Antibiotikum aus der Klasse der Fluorchinolone mit breitem Wirkungsspektrum und hoher Wirksamkeit. Nach oraler Gabe wird Prulifloxacin aus dem Magen-Darm-Trakt resorbiert und sofort in Ulifloxacin, seinen aktiven Metaboliten, umgewandelt (siehe Abschnitt 5.2).
Wirkmechanismus Keraflox hat sich als aktiv erwiesen in vitro, gegen eine Vielzahl von grampositiven und gramnegativen Stämmen. Prulifloxacin übt seine antibakterielle Wirkung aus, indem es selektiv die DNA-Gyrase hemmt, ein lebenswichtiges Enzym in Bakterien, das an der DNA-Duplikation, -Transkription und -Reparatur beteiligt ist.
Widerstandsmechanismus. Der Beginn einer Antibiotikaresistenz gegen Prulifloxacin (sowie gegen andere Fluorchinolone) ist im Allgemeinen auf spontane Mutationen in der bakteriellen DNA-Gyrase-Domäne zurückzuführen. In vitro wurde Kreuzresistenz mit anderen Fluorchinolonen beobachtet.
Aufgrund der besonderen Mechanismen des Auftretens der Resistenz gegen Fluorchinolone gibt es keine Kreuzresistenz zwischen Prulifloxacin und Antibiotika verschiedener Klassen, daher kann Keraflox auch in Gegenwart von Bakterienstämmen wirksam sein, die gegen Aminoglykoside, Penicilline, Cephalosporine und Tetrazykline resistent sind.
Intervalle der Hemmung. Sie wurden auf der Grundlage der antibakteriellen Aktivitätsdaten von NCCLS und der pharmakokinetischen Parameter des Produkts definiert. Folgende Hemmbereiche werden empfohlen: Sensibel: MHK ≤ 1 µg/ml, Mittelstufe: MHK > 1 bis
Antibakterielles Spektrum. Es sollte berücksichtigt werden, dass die Prävalenz erworbener Resistenzen bei ausgewählten Arten geografisch und mit der Zeit variieren kann, daher sind lokale Informationen über Resistenzen wünschenswert, insbesondere bei der Behandlung schwerer Infektionen. Gegebenenfalls und wenn die lokale Resistenzprävalenz den Nutzen des Arzneimittels fraglich machen kann, ist es ratsam, fachkundigen Rat einzuholen.
Die in der folgenden Tabelle aufgeführten Daten zeigen das antibakterielle Spektrum von Prulifloxacin:
* Arten mit einer natürlichen Zwischenempfindlichkeit.
Andere Informationen. In In-vitro-Studien war die antibakterielle Wirkung von Prulifloxacin durch eine bessere Bakterienpenetration und eine länger anhaltende postantibiotische Wirkung als die Referenz-Fluorchinolone gekennzeichnet.
05.2 Pharmakokinetische Eigenschaften
a) Allgemeine Eigenschaften
Prulifloxacin ist das Prodrug des aktiven Metaboliten Ulifloxacin.
Resorption - Beim Menschen wird Prulifloxacin schnell resorbiert (Tmax = ca. 1 Stunde) und in Ulifloxacin umgewandelt, nach einmaliger Gabe von 600 mg beträgt der mittlere Spitzenplasmawert von Ulifloxacin 1,6 µg/ml und die AUC 7,3 µg * h/ml Steady-State, der innerhalb von 2 Tagen nach Beginn der einmal täglichen Dosierung erreicht wird, betragen Cmax und AUC 2,0 µg/ml bzw. 7,6 µg*h/ml.
Die Nahrungsaufnahme verzögert und verringert die maximale Plasmakonzentration von Ulifloxacin geringfügig, ändert jedoch nicht die AUC.
Verteilung - Beim Menschen nimmt das Lungen-Plasma-Verhältnis der mittleren Keraflox-Konzentration mit der Zeit zu und der aktive Metabolit Ulifloxacin behält nach 24 Stunden eine 5-mal höhere mittlere Gewebekonzentration als im Plasma bei, was die beim Tier erhaltenen Ergebnisse bestätigt die Konzentrationen von Ulifloxacin in Lunge und Niere waren höher als im Plasma (1,2 - 2,8-fach bzw. 3 - 8-fach).
Ebenso zeigten Humandaten zur Gewebepenetration von Ulifloxacin in die Nasennebenhöhlen in Bezug auf die AUC ein Gewebe-zu-Plasma-Verhältnis von 3,0 im Siebbein und 2,4 in den Nasenmuscheln.
Proteinbindung beim Menschen, beide bewertet in vitro das Ex-vivo, beträgt ungefähr 50 %, unabhängig von der Arzneimittelkonzentration.
Die geringe Konzentration von Ulifloxacin im Liquor nach i.v. beim Hund und wiederholte Verabreichung p.o. beim Menschen deutet dies darauf hin, dass Ulifloxacin die Blut-Hirn-Schranke kaum passiert.
Biotransformation - Das Stoffwechselprofil von Prulifloxacin bei Tieren und Menschen ist vergleichbar. Tierexperimentelle Studien haben gezeigt, dass die Verstoffwechselung von Prulifloxacin während der intestinalen Resorption beginnt und mit der Passage in die Leber abgeschlossen wird.
Neben der Umwandlung in Ulifloxacin wurden weitere Nebenmetaboliten identifiziert, wie die Diolform und einige Derivate wie Glucuronid, Oxo-Derivate und Ethylen-Diamino-Derivate, deren Konzentration und Aktivität im Vergleich zum Wirkstoff vernachlässigbar sind.
In In-vitro-Studien wurden keine signifikanten Wechselwirkungen mit Cytochrom-P-450-Isoenzymen beobachtet, abgesehen von einer leichten Hemmung von CYP1A1 / 2 entsprechend einer geringfügigen Abnahme der Theophyllin-Clearance. Da Methylxanthine und insbesondere Theophyllin das Hauptsubstrat für das CYP1A1/2-Isoenzym darstellen, kann der Interaktionsgrad mit anderen Substraten des Isoenzyms (siehe Warfarin) nur als geringer angesehen werden.
Elimination - Die Halbwertszeit des aktiven Metaboliten Ulifloxacin beträgt beim Menschen etwa 10 Stunden nach einmaliger und wiederholter Verabreichung im Steady-State, während sie bei Tieren (Ratten, Hunde und Affen) zwischen 2 und 12 Stunden variiert.
Studien mit dem gekennzeichneten Produkt am Menschen haben gezeigt, dass die Elimination hauptsächlich über den Stuhl erfolgt. Nach oraler Gabe von 600 mg beträgt die in Urin und Fäzes wiedergefundene Radioaktivität insgesamt ca. 95 %. Diese Ergebnisse bestätigen, was in früheren Studien an Tieren (Ratten, Hunde und Affen) gezeigt wurde.
Die mit dem Urin ausgeschiedene Ulifloxacin-Menge beträgt 16,7% der verabreichten Dosis auf molarer Basis und die renale Clearance von Ulifloxacin beträgt ca. 170 ml/min.
Die renale Elimination von Ulifloxacin erfolgt durch glomeruläre Filtration und durch aktive Sekretion.
b) Merkmale bei Patienten
Es wurde gezeigt, dass das pharmakokinetische Profil von Prulifloxacin bei älteren Patienten mit dem von Erwachsenen vergleichbar ist und sich nicht mit dem Alter ändert. Daher werden bei älteren Patienten keine Dosisanpassungen für notwendig erachtet.
Bei Patienten mit leichter oder mittelschwerer Niereninsuffizienz erreicht der mittlere Plasmapeak von Ulifloxacin nach oraler Verabreichung von Keraflox 600 mg Werte zwischen 1,30 und 1,62 µg / ml. Die AUC-Werte variieren zwischen 13,71 und 23,33 µg*h/ml und die Halbwertszeit zwischen 12,3 und 32,4 Std. Die renale Clearance von Ulifloxacin nimmt im Vergleich zu gesunden Probanden je nach Insuffizienzgrad ab.
05.3 Präklinische Sicherheitsdaten
Wiederholte Toxizität. In Toxizitätsstudien mit wiederholter Gabe waren Gelenkknorpel, Niere, Magen-Darm-Trakt und Leber die Hauptzielorgane. Bei Dosen, die bis zu dreimal höher waren als die therapeutischen, wurden keine toxischen Wirkungen auf Gelenkknorpel beobachtet (junge Hunde); bei bis zu 6-, 10- und 12-fach höheren Dosen als den therapeutischen wurden keine toxischen Wirkungen auf Leber (Hunde) und Nieren (Hunde und Ratten) beobachtet.
Das Arzneimittel verlängert das QT-Intervall in vivo nicht und zeigt in vitro keine Hemmwirkung auf den Kaliumstrom mit verzögerter Rektifikation (HERG).
Reproduktionstoxizität. Studien zur Reproduktionstoxizität zeigten keine Teratogenität. Auswirkungen auf die Fertilität oder auf die embryonale und fetale Entwicklung wurden nur bei maternaler Toxizität beobachtet.
Mutagenität. Standardgenotoxizitätsassays zeigten in einigen In-vitro-Tests, die mit Prulifloxacin in Säugetierzellkulturen durchgeführt wurden, positive Wirkungen, waren jedoch in vivo und in Bakterien negativ.
Es wird angenommen, dass diese Wirkungen mit der Hemmung der Topoisomerase II in Gegenwart hoher Prulifloxacin-Konzentrationen verbunden sind.
Krebserzeugendes Potenzial. Prulifloxacin erwies sich in einem mittelfristigen Initiations-Promotion-Modell als nicht krebserregend. Langzeittests auf Kanzerogenität wurden nicht durchgeführt.
Antigenität. Prulifloxacin hat keine antigene Wirkung.
Phototoxizität. Prulifloxacin induzierte phototoxische Reaktionen, obwohl in vergleichenden Tierversuchen gezeigt wurde, dass es eine geringere phototoxische Aktivität aufweist als die anderen verwendeten Fluorchinolone (Ofloxacin, Enoxacin, Pefloxacin, Nalidixinsäure und Lomefloxacin). Viele Chinolone sind auch photochemisch-mutagen/photochemisch Es kann nicht ausgeschlossen werden, dass Prulifloxacin auch solche Wirkungen hat.
Nephrotoxizität. Nach wiederholter oraler Verabreichung von 3000 mg/kg/Tag bei Ratten, einer Dosierung, die viel höher ist als die therapeutische Dosis beim Menschen, verursachte Prulifloxacin Kristallurie durch Ausfällung von Ulifloxacin.
Kardiotoxizität. Studien an Hunden haben gezeigt, dass Prulifloxacin keine merklichen Veränderungen im Elektrokardiogramm verursacht, insbesondere wurden weder nach einmaliger intravenöser Gabe beim narkotisierten Hund noch nach oraler Gabe über 6 Monate beim wachen Hund keinerlei Veränderungen des QTc beobachtet. In-vitro-Studien bestätigten das Fehlen einer Hemmwirkung auf verzögerte Kaliumgleichrichterströme (HERG).
Gelenktoxizität. Prulifloxacin verursachte, ähnlich wie andere Fluorchinolone, nur bei jungen Tieren eine Arthropathie.
Augentoxizität. Orale Dosen von 26,4 oder 58,2 mg/kg/Tag Prulifloxacin einmal täglich über 52 Wochen verursachten bei Affen keine behandlungsbedingten Nebenwirkungen auf die Augenfunktion oder -morphologie.
Rhabdomyolytische Wirkung. Dosen von bis zu 10 mg/kg/Tag von Ulifloxacin, die einmal täglich an 14 aufeinander folgenden Tagen intravenös verabreicht wurden, induzierten bei Kaninchen keine Rhabdomyolyse.
06.0 PHARMAZEUTISCHE INFORMATIONEN
06.1 Hilfsstoffe
Kern
Lactose-Monohydrat,
mikrokristalline Cellulose,
Croscarmellose-Natrium,
Povidon,
kolloidales wasserfreies Siliciumdioxid,
Magnesiumstearat
Glasur
Hypromellose,
Propylenglykol,
Titandioxid (E171),
Talk,
Eisenoxid (E172).
06.2 Inkompatibilität
Nicht relevant
06.3 Gültigkeitsdauer
3 Jahre
06.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
In der Originalverpackung aufbewahren.
06.5 Art der unmittelbaren Verpackung und Inhalt des Packstücks
Karton mit 1 Blister mit 1, 2, 5 Filmtabletten oder 2 Blister mit 5 Filmtabletten.
Blister aus Verbundmaterial (Polyamid / Aluminium / PVC) heißversiegelt mit Abdeckmaterial (Aluminium / PVC).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
06.6 Gebrauchs- und Handhabungshinweise
Keine besonderen Anweisungen.
Nicht verwendete Arzneimittel und Abfälle aus diesem Arzneimittel müssen gemäß den örtlichen Vorschriften entsorgt werden.
07.0 INHABER DER MARKETING-ERLAUBNIS
Crinos S.p.A. - Via Pavia, 6 - 20136 Mailand
08.0 NUMMER DER MARKETING-ERLAUBNIS
Schachtel mit 1 Filmtablette mit 600 mg A.I.C. 035680014
Schachtel mit 2 Filmtabletten mit 600 mg A.I.C. 035680026
Schachtel mit 5 Filmtabletten mit 600 mg A.I.C. 035680038
Schachtel mit 10 Filmtabletten mit 600 mg A.I.C. 035680040
09.0 DATUM DER ERSTEN GENEHMIGUNG ODER ERNEUERUNG DER GENEHMIGUNG
Datum der Erstzulassung: 21. Juni 2004
Genehmigungsverlängerungsdatum: 21. Juni 2009
10.0 DATUM DER ÜBERARBEITUNG DES TEXTs
Februar 2017