Wirkstoffe: Etanercept
Enbrel 50 mg Injektionslösung in einem Fertigpen
Enbrel Packungsbeilagen sind für Packungsgrößen erhältlich:- Enbrel 25 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
- Enbrel 25 mg Injektionslösung in Fertigspritzen
- Enbrel 50 mg Injektionslösung in Fertigspritzen
- Enbrel 50 mg Injektionslösung in einem Fertigpen
- Enbrel 10 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung für Kinder
Warum wird Enbrel verwendet? Wofür ist das?
Enbrel ist ein biologisches Arzneimittel, das aus zwei menschlichen Proteinen besteht. Es blockiert die Aktivität eines anderen Proteins, das im menschlichen Körper Entzündungen verursacht. Enbrel wirkt, indem es die mit einigen Krankheiten verbundenen Entzündungen reduziert.
Bei Erwachsenen (ab 18 Jahren) kann Enbrel zur Behandlung von mittelschwerer bis schwerer rheumatoider Arthritis, Psoriasis-Arthritis, schwerer axialer Spondyloarthritis, einschließlich ankylosierender Spondylitis, und mittelschwerer bis schwerer Psoriasis angewendet werden nicht gut genug gewirkt haben oder für Sie nicht geeignet sind.
Bei rheumatoider Arthritis wird Enbrel normalerweise in Kombination mit Methotrexat angewendet, obwohl es auch allein angewendet werden kann, wenn eine Methotrexat-Behandlung für Sie nicht geeignet ist.Ob allein oder in Kombination mit Methotrexat angewendet, kann Enbrel die durch rheumatoide Arthritis verursachten Gelenkschäden verlangsamen und verbessert die Fähigkeit, normale tägliche Aktivitäten auszuführen.
Bei Patienten mit Psoriasis-Arthritis mit Beteiligung mehrerer Gelenke kann Enbrel die Fähigkeit zur Ausübung alltäglicher Aktivitäten verbessern. Bei Patienten mit schmerzhaften oder geschwollenen mehreren symmetrischen Gelenken (z. B. Hände, Handgelenke und Füße) kann Enbrel die durch die Krankheit verursachten strukturellen Schäden an diesen Gelenken verlangsamen.
Enbrel wird auch zur Behandlung der folgenden Erkrankungen bei Kindern und Jugendlichen verschrieben:
- Bei folgenden Arten der juvenilen idiopathischen Arthritis, wenn die Methotrexat-Behandlung nicht ausreichend gut anspricht oder nicht angemessen ist: Polyarthritis (Rheumafaktor positiv oder negativ) und ausgedehnte Oligoarthritis bei Patienten ab 2 Jahren; Psoriasis-Arthritis bei Patienten ab dem Alter von vom 12.
- Bei Enthesitis-assoziierter Arthritis bei Patienten ab 12 Jahren, wenn andere weit verbreitete Behandlungen kein ausreichend gutes Ansprechen gezeigt haben oder nicht geeignet sind.
- Schwere Psoriasis bei Patienten ab 6 Jahren, die auf Phototherapien oder andere systemische Therapien unzureichend angesprochen haben (oder diese nicht einnehmen können).
Kontraindikationen Wenn Enbrel nicht angewendet werden sollte
Verwenden Sie Enbrel nicht:
- wenn Sie oder das Kind allergisch gegen Etanercept oder einen der in Abschnitt 6. genannten sonstigen Bestandteile von Enbrel sind. Wenn bei Ihnen oder dem Kind allergische Reaktionen wie Engegefühl in der Brust, Kurzatmigkeit, Schwindel oder Hautausschlag auftreten, injizieren Sie nicht mehr Enbrel und wenden Sie sich sofort an Ihren Arzt.
- wenn Sie oder das Kind eine „schwere Blutinfektion namens Sepsis“ haben oder Gefahr laufen, eine solche zu entwickeln. Wenn Sie sich nicht sicher sind, wenden Sie sich bitte an Ihren Arzt.
- wenn Sie oder das Kind eine Infektion jeglicher Art haben. Wenn Sie sich nicht sicher sind, sprechen Sie mit Ihrem Arzt.
Vorsichtsmaßnahmen für die Anwendung Was sollten Sie vor der Einnahme von Enbrel® beachten?
- Allergische Reaktionen: Wenn bei Ihnen oder dem Kind allergische Reaktionen wie Engegefühl in der Brust, Keuchen, Schwindel oder Hautausschlag auftreten, injizieren Sie nicht mehr Enbrel und wenden Sie sich sofort an Ihren Arzt.
- Infektionen/Operationen: Wenn bei Ihnen oder dem Kind eine neue Infektion auftritt oder eine größere Operation bevorsteht, wird Ihr Arzt möglicherweise Ihre Behandlung mit Enbrel überprüfen.
- Infektionen/Diabetes: Informieren Sie Ihren Arzt, wenn Sie oder das Kind in der Vorgeschichte wiederkehrende Infektionen haben oder an Diabetes oder anderen Erkrankungen leiden, die das Infektionsrisiko erhöhen.
- Infektionen / Überwachung: Informieren Sie Ihren Arzt über jede kürzliche Reise außerhalb Europas.Wenn Sie oder Ihr Kind Symptome einer Infektion wie Fieber, Schüttelfrost oder Husten entwickeln, informieren Sie sofort Ihren Arzt. Ihr Arzt wird möglicherweise entscheiden, Sie oder Ihr Kind weiterhin auf Infektionen zu überwachen, nachdem Sie oder Ihr Kind die Einnahme von Enbrel beendet haben.
- Tuberkulose: Da bei mit Enbrel behandelten Patienten Fälle von Tuberkulose berichtet wurden, wird Ihr Arzt Sie vor Beginn der Behandlung mit Enbrel auf Anzeichen und Symptome einer Tuberkulose untersuchen. Dies kann eine gründliche Erhebung Ihrer Krankengeschichte, Röntgenaufnahmen des Brustkorbs und ein Tuberkulintest umfassen. Die Ergebnisse dieser Tests sollten auf dem Patientenpass vermerkt werden. Es ist sehr wichtig, dass Sie Ihren Arzt informieren, wenn Sie oder das Kind jemals an Tuberkulose erkrankt sind oder engen Kontakt mit jemandem hatten, der an Tuberkulose erkrankt ist Husten, Gewichtsverlust, Schwäche, leichtes Fieber) oder jede andere Infektion, die während oder nach der Therapie auftritt, informieren Sie unverzüglich Ihren Arzt.
- Hepatitis B: Informieren Sie Ihren Arzt, wenn Sie oder Ihr Kind Hepatitis B haben oder jemals hatten. Ihr Arzt muss einen Hepatitis-B-Test durchführen, bevor Sie oder Ihr Kind mit der Behandlung mit Enbrel beginnen. Die Behandlung mit Enbrel kann bei Patienten mit früherer Hepatitis zu einer Reaktivierung der Hepatitis B führen Infektion mit dem Virus B. In diesem Fall sollten Sie die Anwendung von Enbrel abbrechen.
- Hepatitis C: Informieren Sie Ihren Arzt, wenn Sie oder das Kind Hepatitis C haben. Ihr Arzt wird möglicherweise Ihre Behandlung mit Enbrel überwachen, wenn sich die Infektion verschlimmert.
- Erkrankungen des Blutes: Suchen Sie sofort einen Arzt auf, wenn Sie oder das Kind Anzeichen oder Symptome wie anhaltendes Fieber, Halsschmerzen, blaue Flecken, Blutungen oder Blässe haben. Diese Symptome können auf das Vorliegen potenziell lebensbedrohlicher Blutkrankheiten hinweisen, die eine Beendigung der Einnahme von Enbrel erforderlich machen können.
- Erkrankungen des Nervensystems und der Augen: Informieren Sie Ihren Arzt, wenn Sie oder das Kind an Multipler Sklerose, Optikusneuritis (Entzündung der Sehnerven) oder transverser Myelitis (Entzündung des Rückenmarks) leiden. Ihr Arzt wird prüfen, ob Enbrel eine geeignete Behandlung ist.
- Kongestive Herzinsuffizienz: Informieren Sie Ihren Arzt, wenn Sie oder das Kind in der Vorgeschichte eine kongestive Herzinsuffizienz hatten, da Enbrel unter diesen Umständen mit Vorsicht angewendet werden sollte.
- Krebs: Informieren Sie Ihren Arzt, wenn Sie ein Lymphom (eine Art von Blutkrebs) oder eine andere Krebsart haben oder jemals hatten, bevor Sie Enbrel einnehmen. Patienten mit langfristiger schwerer rheumatoider Arthritis können ein überdurchschnittlich hohes Risiko haben, ein Lymphom zu entwickeln. Kinder und Erwachsene, die Enbrel einnehmen, können ein höheres Risiko haben, an Lymphomen oder anderen Krebsarten zu erkranken. Einige Kinder und jugendliche Patienten, die mit Enbrel oder mit anderen Arzneimitteln, die wie Enbrel wirken, behandelt wurden, entwickelten Krebs, einschließlich ungewöhnlicher Arten, manchmal mit tödlichem Ausgang. Einige Patienten, die Enbrel erhielten, entwickelten Hautkrebs. Informieren Sie Ihren Arzt, wenn bei Ihnen oder dem Kind Veränderungen des Hautbildes oder Wucherungen auf der Haut auftreten.
- Windpocken: Informieren Sie Ihren Arzt, wenn Sie oder das Kind während der Anwendung von Enbrel Windpocken ausgesetzt sind. Ihr Arzt wird prüfen, ob eine vorbeugende Behandlung von Windpocken angemessen ist.
- Latex: Die Nadelschutzkappe besteht aus Latex (getrockneter Naturkautschuk).Wenn Sie mit der Nadelschutzkappe hantieren oder wenn Enbrel einer Person mit bekannter oder möglicher Überempfindlichkeit (Allergie) gegen Latex verabreicht wird, wenden Sie sich vor der Anwendung von Enbrel an Ihren Arzt.
- Alkoholmissbrauch: Enbrel sollte nicht zur Behandlung von alkoholbedingter Hepatitis angewendet werden. Informieren Sie Ihren Arzt, wenn Sie oder das Kind Alkoholmissbrauch in der Vorgeschichte haben.
- Wegener-Granulomatose: Enbrel wird nicht zur Behandlung der Wegener-Granulomatose, einer seltenen entzündlichen Erkrankung, empfohlen. Wenn Sie oder das Kind eine Wegener-Granulomatose haben, sprechen Sie mit Ihrem Arzt.
- Arzneimittel gegen Diabetes: Informieren Sie Ihren Arzt, wenn Sie oder das Kind an Diabetes leiden oder Arzneimittel zur Behandlung von Diabetes einnehmen. Ihr Arzt kann entscheiden, ob Sie oder Ihr Kind während der Einnahme von Enbrel weniger Diabetes-Medikamente benötigen.
Kinder und Jugendliche
- Impfungen: Wenn möglich, sollten Kinder vor der Anwendung von Enbrel über alle Impfungen informiert sein. Einige Impfstoffe, wie z. B. der orale Polioimpfstoff, dürfen während der Einnahme von Enbrel nicht eingenommen werden. Konsultieren Sie Ihren Arzt, bevor Sie oder Ihr Kind geimpft werden.
- Entzündliche Darmerkrankung (IBD): Es gab Fälle von entzündlichen Darmerkrankungen bei Patienten mit juveniler idiopathischer Arthritis (JIA), die mit Enbrel behandelt wurden. Informieren Sie Ihren Arzt, wenn bei Ihrem Kind Bauchkrämpfe und -schmerzen, Durchfall, Gewichtsverlust oder Blut im Stuhl auftritt.
Enbrel sollte normalerweise nicht bei Kindern mit Polyarthritis oder ausgedehnter Oligoarthritis unter 2 Jahren oder bei Kindern mit Enthesitis-assoziierter Arthritis oder Psoriasis-Arthritis unter 12 Jahren oder bei Kindern mit Psoriasis unter 6 Jahren angewendet werden. .
Wechselwirkungen Welche Medikamente oder Lebensmittel können die Wirkung von Enbrel® verändern?
Einnahme von Enbrel® zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie oder das Kind andere Arzneimittel einnehmen, kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen andere Arzneimittel einzunehmen (einschließlich Anakinra, Abatacept oder Sulfasalazin), auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Sie oder das Kind dürfen Enbrel nicht zusammen mit dem Wirkstoff Anakinra oder Abatacept anwenden.
Warnungen Es ist wichtig zu wissen, dass:
Schwangerschaft und Stillzeit
Die Auswirkungen von Enbrel auf schwangere Frauen sind nicht bekannt, daher wird die Anwendung von Enbrel während der Schwangerschaft nicht empfohlen Frauen, die Enbrel anwenden, sollten eine Schwangerschaft vermeiden.
Wenn Sie oder das Mädchen / Mädchen schwanger werden, sollten Sie Ihren Arzt aufsuchen. Wenn Sie oder das Mädchen/das Mädchen während der Schwangerschaft Enbrel erhalten hat, kann das Baby einem erhöhten Infektionsrisiko ausgesetzt sein. Es ist wichtig, neugeborene Kinderärzte und anderes medizinisches Fachpersonal über die Anwendung von Enbrel während der Schwangerschaft zu informieren, bevor das Neugeborene einen Impfstoff erhält (weitere Informationen finden Sie in Abschnitt 2 „Impfungen“).
Frauen, die Enbrel anwenden, sollten nicht stillen, da Enbrel in die Muttermilch übergeht.
Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wird nicht erwartet, dass die Anwendung von Enbrel Ihre Verkehrstüchtigkeit oder Ihre Fähigkeit zum Bedienen von Maschinen beeinträchtigt.
Dosis, Methode und Zeitpunkt der Anwendung Wie ist Enbrel anzuwenden: Dosierung
Wenden Sie Enbrel immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie im Zweifelsfall Ihren Arzt oder Apotheker.
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Enbrel zu stark oder zu schwach ist.
Ihr wurde Enbrel in einer Stärke von 50 mg verschrieben. Eine 25-mg-Stärke von Enbrel ist für 25-mg-Dosen erhältlich.
Dosis für erwachsene Patienten
Rheumatoide Arthritis, Psoriasis-Arthritis und axiale Spondyloarthritis, einschließlich Spondylitis ankylosans
Die übliche Dosis beträgt 25 mg zweimal wöchentlich oder 50 mg einmal wöchentlich als subkutane Injektion. In jedem Fall kann Ihr Arzt eine andere Häufigkeit der Injektion von Enbrel festlegen.
Plaque-Psoriasis
Die übliche Dosis beträgt 25 mg zweimal wöchentlich oder 50 mg einmal wöchentlich.
Alternativ kann eine Dosis von 50 mg zweimal wöchentlich für bis zu 12 Wochen verabreicht werden, gefolgt von einer Dosis von 25 mg zweimal wöchentlich oder einer Dosis von 50 mg einmal wöchentlich.
Ihr Arzt wird entscheiden, wie lange Sie Enbrel einnehmen müssen und ob aufgrund Ihres Ansprechens eine neue Behandlung erforderlich ist. Wenn Enbrel nach 12 Wochen keinen Einfluss auf Ihre Krankheit hat, wird Ihr Arzt Ihnen möglicherweise anweisen, die Behandlung abzubrechen.
Anwendung bei Kindern und Jugendlichen
Die geeignete Dosis und Dosierungshäufigkeit für Ihr Kind oder Jugendlichen hängt von seinem Körpergewicht und seiner Erkrankung ab.Ihr Arzt wird die richtige Dosis für Ihr Kind bestimmen und eine geeignete Stärke von Enbrel (10 mg, 25 mg oder 50 mg) verschreiben.
Bei Polyarthritis oder ausgedehnter Oligoarthritis bei Patienten ab 2 Jahren oder Enthesitis-assoziierter Arthritis oder Psoriasis-Arthritis bei Patienten ab 12 Jahren beträgt die übliche Dosis 0,4 mg Enbrel pro kg Körpergewicht (bis maximal 25 mg .). ), zweimal wöchentlich oder 0,8 mg Enbrel pro kg Körpergewicht (bis maximal 50 mg) einmal wöchentlich.
Bei Psoriasis bei Patienten ab 6 Jahren beträgt die übliche Dosis 0,8 mg Enbrel pro Kilogramm Körpergewicht (bis maximal 50 mg) und sollte einmal wöchentlich verabreicht werden Wochen kann Ihr Arzt Ihnen sagen, dass Sie die Einnahme dieses Arzneimittels abbrechen sollen.
Ihr Arzt wird Sie ausführlich darüber informieren, wie Sie die geeignete Dosierung vorbereiten und abmessen.
Art und Weise der Verabreichung
Enbrel wird unter die Haut gespritzt (subkutane Injektion).
Enbrel kann mit oder ohne Nahrung und Getränke eingenommen werden.
Ausführliche Anweisungen zur Injektion von Enbrel finden Sie in Abschnitt 7, „Anleitung zur Vorbereitung und Verabreichung einer“ Enbrel-Injektion. „Die Enbrel-Lösung nicht mit anderen Arzneimitteln mischen.
Damit Sie sich besser erinnern können, kann es hilfreich sein, in ein Tagebuch zu schreiben, an welchen Wochentagen Enbrel angewendet werden sollte.
Anweisungen zur Vorbereitung und Verabreichung einer Enbrel®-Injektion
Einführung
Die folgenden Anweisungen erklären, wie Sie Enbrel mit dem MYCLIC-Pen injizieren. Lesen Sie die Anweisungen sorgfältig durch und befolgen Sie sie Schritt für Schritt. Ihr Arzt oder das medizinische Fachpersonal wird Ihnen sagen, wie Enbrel zu injizieren ist. Versuchen Sie nicht zu injizieren, bis Sie sicher sind, wie Sie den MYCLIC Pen richtig anwenden.Wenn Sie Fragen zur Injektion haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
Schritt 1: Vorbereitung der Injektion
- Wählen Sie eine saubere, gut beleuchtete und ebene Arbeitsfläche.
- Nehmen Sie die Materialien, die Sie für die Injektion benötigen, und legen Sie sie auf die gewählte Oberfläche: a) Einen MYCLIC-Fertigpen und einen Alkoholtupfer (entnehmen Sie diese aus der im Kühlschrank aufbewahrten Pen-Packung). Schütteln Sie den Pen nicht Ein Wattestäbchen oder Gaze
- Inspizieren Sie die Lösung im Pen, indem Sie durch das durchsichtige Sichtfenster schauen. Die Lösung sollte klar bis leicht opaleszierend, farblos oder blassgelb sein und kann kleine weiße oder fast transparente Proteinpartikel enthalten. Dies ist das normale Aussehen von Enbrel. Verwenden Sie diese Lösung nicht, wenn sie verfärbt oder trüb ist oder andere als die beschriebenen Partikel sichtbar sind.Wenn Sie sich bezüglich des Aussehens der Lösung nicht sicher sind, wenden Sie sich an Ihren Apotheker.
- Lassen Sie die weiße Nadelschutzkappe aufgesetzt und warten Sie ca. 15-30 Minuten, damit die Enbrel-Lösung im Pen Raumtemperatur erreichen kann. Erhitzen Sie es nicht auf andere Weise. Bewahren Sie den Pen immer außerhalb der Sicht- und Reichweite von Kindern auf.
Während Sie darauf warten, dass die Lösung im Pen Raumtemperatur erreicht, lesen Sie Schritt 2 (unten) und wählen Sie eine Injektionsstelle.
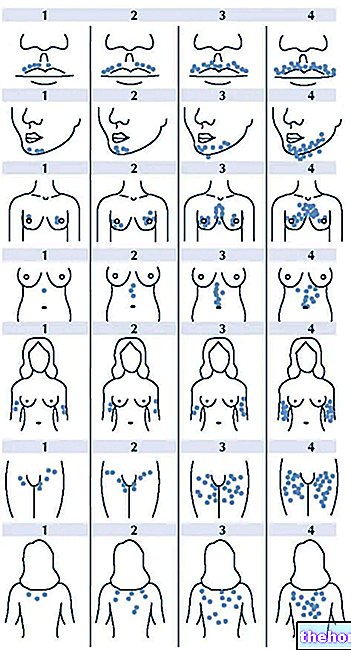
Schritt 2: Wählen Sie eine Injektionsstelle
- Die empfohlene Injektionsstelle ist die vordere Mitte der Oberschenkel; Sie können alternativ auch den Bauchbereich verwenden, aber Sie sollten darauf achten, dass Sie eine Stelle wählen, die mindestens 5 cm vom Nabel entfernt ist. Wenn Ihnen jemand die Injektion verabreicht auch der äußere Bereich der Oberarme verwendet werden.
- Jede Injektion sollte mindestens 3 cm von der Stelle entfernt erfolgen, an der die vorherige Injektion vorgenommen wurde. Nicht in Bereiche mit empfindlicher, geröteter oder harter Haut injizieren. Vermeiden Sie Bereiche mit Narben oder Dehnungsstreifen (es kann hilfreich sein, die Lage früherer Injektionsstellen zu notieren).
- Wenn Sie an Psoriasis leiden, sollten Sie versuchen, nicht direkt in geschwollene, verdickte, gerötete oder schuppige Hautbereiche zu injizieren.
Schritt 3: Injizieren Sie die Enbrel-Lösung
- Nachdem Sie etwa 15-30 Minuten gewartet haben, bis die Lösung im Pen Raumtemperatur erreicht hat, waschen Sie Ihre Hände mit Wasser und Seife.
- Reinigen Sie die Injektionsstelle mit dem Alkoholtupfer in kreisenden Bewegungen und lassen Sie sie trocknen. Berühren Sie diesen Bereich vor der Injektion nicht mehr.
- Nehmen Sie den Pen und entfernen Sie die weiße Nadelschutzkappe, indem Sie sie fest von der Spritze abziehen (siehe Abbildung 3). Um eine Beschädigung der Nadel im Pen zu vermeiden, biegen Sie die weiße Nadelschutzkappe beim Abnehmen nicht und bringen Sie sie nicht wieder an das wurde abgenommen. Nach dem Entfernen der Nadelschutzkappe ragt ein lila-violetter Nadelschutz etwas aus dem Ende des Pens heraus. Die Nadel bleibt im Pen geschützt, bis der Pen aktiviert wird.
- Durch leichtes Kneifen der Haut mit Daumen und Zeigefinger der freien Hand können Sie leichter und bequemer injizieren.
- Halten Sie den Pen im rechten Winkel (90 °) zur Injektionsstelle. Drücken Sie nicht die grüne Aktivierungstaste oben am Stift. Drücken Sie das offene Ende des Pens fest auf die Haut, sodass der Nadelschutz ganz in den Pen eingeschoben wird. Auf der Haut ist eine leichte Vertiefung zu sehen (siehe Abbildung 4). Sie werden feststellen, dass die grüne Aktivierungstaste gesperrt bleibt und der Pen nicht aktiviert wird, es sei denn, der Nadelschutz wird vollständig in den Pen eingeschoben.
- Drücken Sie den Pen fest auf die Haut und vergewissern Sie sich, dass das Nadelsicherheitssystem vollständig in den Pen eingeführt ist, drücken Sie mit dem Daumen und lassen Sie sofort den grünen Knopf oben am Pen los, um die Injektion zu starten (siehe Abbildung 5). Drücken Sie den Stift weiter fest gegen Ihre Haut, bis Sie ein zweites Klicken oder 10 Sekunden nach dem ersten Klicken hören (je nachdem, was zuerst eintritt) der erste Klick, andernfalls erfolgt kein zweiter Klick, wenn die Injektion abgeschlossen ist. Es ist nicht erforderlich, den Daumen auf dem grünen Knopf zu halten, um Enbrel zu injizieren.
- Wenn das zweite „Klicken“ zu hören ist (oder, wenn das zweite „Klicken“ nicht zu hören ist, nach Ablauf von 10 Sekunden), ist die Injektion abgeschlossen (siehe Abbildung 6). Sie können nun den Pen von der Haut abheben (siehe Abbildung 6) 7.) Wenn Sie den Pen anheben, fährt der lila-violette Nadelschutz automatisch aus, um die Nadel abzudecken.
- Das Sichtfenster des Pens sollte jetzt vollständig violett sein, was bestätigt, dass die Dosis korrekt injiziert wurde. Wenn das Fenster nicht vollständig violett ist, wenden Sie sich an Ihr medizinisches Fachpersonal oder Ihren Apotheker, da der Pen die Enbrel-Lösung möglicherweise nicht vollständig injiziert hat. Versuchen Sie nicht, den Pen erneut zu verwenden und versuchen Sie nicht, einen anderen Pen ohne ihn zu verwenden Ihre Krankenschwester oder Ihr Apotheker.
- Wenn Sie einen Blutfleck an der Injektionsstelle bemerken, drücken Sie den Wattebausch oder die Gaze 10 Sekunden lang auf die Injektionsstelle. Reiben Sie die Injektionsstelle nicht.
Schritt 4: Entsorgen Sie den gebrauchten MYCLIC-Stift
- Der Pen ist nur zum einmaligen Gebrauch bestimmt - er darf nie wiederverwendet werden. Entsorgen Sie den gebrauchten Pen gemäß den Anweisungen Ihres Arztes, des medizinischen Fachpersonals oder Apothekers.
Wenn Sie Fragen haben, wenden Sie sich an einen mit Enbrel vertrauten Arzt, das medizinische Fachpersonal oder Apotheker.
Überdosierung Was ist zu tun, wenn Sie zu viel Enbrel® eingenommen haben?
Wenn Sie eine größere Menge von Enbrel angewendet haben, als Sie sollten:
Wenn Sie eine größere Menge von Enbrel eingenommen haben, als Sie sollten (entweder durch einmalige Injektion oder zu häufige Anwendung), sprechen Sie sofort mit Ihrem Arzt oder Apotheker Nehmen Sie die Arzneimittelpackung immer mit, auch wenn sie leer ist.
Wenn Sie die Einnahme von Enbrel vergessen haben:
Wenn Sie eine Dosis vergessen haben, verabreichen Sie diese, sobald Sie die vergessene Dosis bemerken, es sei denn, die nächste Dosis ist für den nächsten Tag vorgesehen. In diesem Fall sollten Sie die vergessene Dosis auslassen. Fahren Sie dann mit der Verabreichung des Arzneimittels an den vorgesehenen Tagen fort. Wenn Sie Ihre Dosis bis zum Fälligkeitstag Ihrer nächsten Dosis vergessen haben, nehmen Sie nicht die doppelte Dosis (zwei Dosen am selben Tag) ein, wenn Sie die vorherige Einnahme vergessen haben.
Wenn Sie die Einnahme von Enbrel abbrechen:
Die Krankheitssymptome können nach Beendigung der Behandlung zurückkehren.Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Nebenwirkungen Was sind die Nebenwirkungen von Enbrel®
Wie alle Arzneimittel kann Enbrel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Allergische Reaktionen
Wenn eine der folgenden Nebenwirkungen auftritt, injizieren Sie Enbrel nicht mehr. Informieren Sie sofort Ihren Arzt oder gehen Sie in die Notaufnahme des nächstgelegenen Krankenhauses.
- Schwierigkeiten beim Schlucken oder Atmen
- Schwellung von Gesicht, Hals, Händen oder Füßen
- Nervosität oder Angst, Herzklopfen, plötzliche Rötung der Haut und/oder Wärmegefühl
- Schwerer Hautausschlag, Juckreiz, Nesselsucht (erhabene Flecken roter oder heller Haut, die oft jucken)
Schwere allergische Reaktionen sind selten. Jedes der oben genannten Symptome kann jedoch auf eine allergische Reaktion auf Enbrel hinweisen; Daher müssen Sie sofort einen Arzt aufsuchen.
Schwere Nebenwirkungen
Wenn Sie eines der folgenden Symptome bemerken, benötigen Sie oder Ihr Kind möglicherweise dringend ärztliche Hilfe.
- Symptome schwerer Infektionen wie hohes Fieber, das von Husten, Kurzatmigkeit, Schüttelfrost, Schwäche oder einem heißen, roten, empfindlichen, wunden Bereich der Haut oder der Gelenke begleitet sein kann.
- Symptome von Blutkrankheiten wie Blutungen, Blutergüsse oder Blässe.
- Symptome von Nervenveränderungen wie Taubheitsgefühl oder Kribbeln, Sehstörungen, Augenschmerzen oder beginnende Schwäche in einem Arm oder Bein.
- Symptome einer sich verschlimmernden Herzinsuffizienz, wie Müdigkeit oder Kurzatmigkeit während der Aktivität, geschwollene Knöchel, geschwollenes Gefühl im Nacken oder Bauch, nächtliche Atemnot oder Husten, bläuliche Farbe der Nägel oder Lippen.
- Symptome von Tumoren: Tumore können jeden Teil des Körpers betreffen, einschließlich Haut und Blut, und die möglichen Symptome hängen von der Art und Lage des Tumors ab. Diese Symptome können Gewichtsverlust, Fieber, Schwellungen (mit oder ohne Schmerzen), anhaltender Husten, das Vorhandensein von Zysten oder Wucherungen auf der Haut umfassen.
- Symptome von Autoimmunreaktionen (bei denen Antikörper gebildet werden, die normales Körpergewebe schädigen können), wie Schmerzen, Juckreiz, Schwäche, Anomalien in Atmung, Denken, Fühlen oder Sehen.
- Symptome von Lupus oder Lupus-ähnlichem Syndrom, wie Veränderungen des Körpergewichts, anhaltender Hautausschlag, Fieber, Gelenk- oder Muskelschmerzen oder Müdigkeit.
- Symptome einer Entzündung der Blutgefäße wie Schmerzen, Fieber, Rötung oder Wärme der Haut oder Juckreiz.
Diese Nebenwirkungen sind selten oder gelegentlich, aber es handelt sich um schwerwiegende Erkrankungen (von denen einige selten zum Tod führen können). Wenn diese Symptome auftreten, informieren Sie sofort Ihren Arzt oder gehen Sie in die nächste Notaufnahme eines Krankenhauses.
Zu den bekannten Nebenwirkungen von Enbrel gehören die folgenden, gruppiert nach abnehmender Häufigkeit:
- Sehr häufig (kann mehr als 1 von 10 Patienten betreffen): Infektionen (einschließlich Erkältungen, Sinusitis, Bronchitis, Harnwegsinfektionen und Hautinfektionen); Reaktionen an der Injektionsstelle (einschließlich Blutungen, Blutergüsse, Rötung, Juckreiz, Schmerzen und Schwellungen) Reaktionen an der Injektionsstelle (diese treten nach dem ersten Behandlungsmonat nicht so häufig auf) Einige Patienten haben eine Reaktion an einer Stelle entwickelt, an der sie zuvor injiziert wurde.
- Häufig (kann bis zu 1 von 10 Patienten betreffen): Allergische Reaktionen; Fieber; jucken; gegen normales Gewebe gerichtete Antikörper (Bildung von Autoantikörpern)
- Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen): Schwere Infektionen (einschließlich Lungenentzündung, tiefe Hautinfektionen, Gelenkinfektionen, Blutinfektionen und Infektionen an verschiedenen Stellen); reduzierte Anzahl von Blutplättchen im Blut; Hautkrebs (außer Melanom); lokalisierte Schwellung der Haut (Angioödem); Nesselsucht (erhabene Flecken roter oder heller Haut, die oft jucken); Augenentzündung; Psoriasis (erstes Auftreten oder Verschlimmerung), Hautausschlag; Entzündung oder Vernarbung der Lunge; Entzündung der Blutgefäße, die mehr als ein Organ betrifft.
- Selten (kann bis zu 1 von 1000 Behandelten betreffen): Schwere allergische Reaktionen (einschließlich schwerer lokaler Hautschwellungen und Atembeschwerden); Lymphom (eine Art von Blutkrebs); Melanom (eine Art von Hautkrebs); gemeinsame Verringerung der Anzahl von Blutplättchen, roten Blutkörperchen und weißen Blutkörperchen; Veränderungen des Nervensystems (mit schwerer Muskelschwäche und ähnlichen Anzeichen und Symptomen wie bei Multipler Sklerose oder Entzündung der Nerven im Auge oder Rückenmark), Tuberkulose, Verschlechterung der Herzinsuffizienz, Krämpfe; Lupus oder Lupus-ähnliches Syndrom (Symptome können "anhaltender Hautausschlag, Fieber, Gelenkschmerzen und Müdigkeit) sein; niedrige Anzahl roter Blutkörperchen, niedrige Anzahl weißer Blutkörperchen, niedrige Anzahl an Neutrophilen (eine Art weißer Blutkörperchen); erhöhte Blutleber; Hautausschlag, der zu starker Blasenbildung und Abschälen der Haut führen kann; Entzündung der Leber, die durch Ihr Immunsystem verursacht wird (Autoimmunhepatitis); Immunerkrankung, die Lunge, Haut und Lymphknoten betreffen kann (Sarkoidose).
- Sehr selten (kann bis zu 1 von 10.000 Behandelten betreffen): Unfähigkeit des Knochenmarks, lebenswichtige Blutzellen zu produzieren.
- Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar): Leukämie (ein Krebs, der das Blut und das Knochenmark betrifft); Merkelzellkarzinom (eine Art von Hautkrebs); übermäßige Aktivierung weißer Blutkörperchen im Zusammenhang mit einer Entzündung (Makrophagen-Aktivierungssyndrom); Wiederauftreten von Hepatitis B (eine Leberinfektion); Verschlechterung einer Erkrankung namens Dermatomyositis (Muskelentzündung und -schwäche, begleitet von einem Hautausschlag).
Nebenwirkungen bei Kindern und Jugendlichen
Die bei Kindern und Jugendlichen beobachteten Nebenwirkungen und deren Häufigkeit ähneln den oben beschriebenen.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker, einschließlich aller möglichen Nebenwirkungen, die nicht in dieser Packungsbeilage aufgeführt sind. Sie können Nebenwirkungen auch direkt über das in Anhang V aufgeführte nationale Meldesystem melden. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
Ablauf und Aufbewahrung
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Enbrel darf nach dem auf der Verpackung und dem Etikett nach „EXP“ angegebenen Verfallsdatum nicht mehr verwendet werden. Das Verfallsdatum bezieht sich auf den letzten Tag dieses Monats.
Im Kühlschrank lagern (zwischen 2 ° C und 8 ° C).
Nicht einfrieren.
Bewahren Sie die Fertigpens im Umkarton auf, um sie vor Licht zu schützen
Nachdem Sie eine Spritze aus dem Kühlschrank genommen haben, warten Sie ungefähr 15-30 Minuten, damit die Enbrel-Lösung in der Spritze Raumtemperatur erreicht. Erhitzen Sie es nicht auf andere Weise. Daher wird eine sofortige Anwendung empfohlen.
Enbrel kann bei einer maximalen Temperatur von 25 ° C bis zu 4 Wochen lang nur einmal gelagert werden; nach dieser Zeit kann es nicht wieder in den Kühlschrank gestellt werden. Wenn Enbrel nicht innerhalb von 4 Wochen außerhalb des Kühlschranks verwendet wird, sollte es entsorgt werden. Es wird empfohlen, das Datum der Entnahme von Enbrel aus dem Kühlschrank und das Datum, bis zu dem Enbrel entsorgt werden muss, zu notieren (nicht länger als 4 Wochen außerhalb des Kühlschranks).
Überprüfen Sie die Lösung in der Spritze. Die Lösung sollte klar bis leicht opaleszierend, farblos oder blassgelb sein und kann kleine weiße oder fast transparente Proteinpartikel enthalten. Dies ist das normale Aussehen von Enbrel. Verwenden Sie diese Lösung nicht, wenn sie verfärbt oder trüb ist oder andere als die beschriebenen Partikel sichtbar sind. Wenn Sie sich bezüglich des Aussehens der Lösung nicht sicher sind, wenden Sie sich an Ihren Apotheker.
Werfen Sie Arzneimittel nicht in das Abwasser oder den Hausmüll. Fragen Sie Ihren Apotheker, wie Sie Arzneimittel, die Sie nicht mehr verwenden, entsorgen sollen. Dies trägt zum Schutz der Umwelt bei.
Zusammensetzung und Darreichungsform
Was Enbrel enthält
Der Wirkstoff von Enbrel ist Etanercept. Jeder MYCLIC-Fertigpen enthält 50 mg Etanercept.
Die sonstigen Bestandteile sind Saccharose, Natriumchlorid, L-Argininhydrochlorid, monobasisches Natriumphosphat-Dihydrat und Dinatriumphosphat-Dihydrat sowie Wasser für Injektionszwecke.
Wie Enbrel aussieht und Inhalt der Packung
Enbrel wird als Injektionslösung in einem Fertigpen (MYCLIC) (Injektionslösung) geliefert. Der MYCLIC-Pen enthält eine klare, farblose oder blassgelbe Injektionslösung. Jede Packung enthält 2, 4 oder 12 Fertigpens und 2, 4 oder 12 Alkoholtupfer. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Quelle Packungsbeilage: AIFA (Italienische Arzneimittelbehörde). Im Januar 2016 veröffentlichter Inhalt. Die vorliegenden Informationen können nicht aktuell sein.
Um Zugriff auf die aktuellste Version zu haben, ist es ratsam, auf die Website der AIFA (Italienische Arzneimittelbehörde) zuzugreifen. Haftungsausschluss und nützliche Informationen.
01.0 BEZEICHNUNG DES ARZNEIMITTELS
ENBREL 50 MG LÖSUNG ZUR INJEKTION FERTIGSPRITZE
02.0 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Fertigspritze enthält 50 mg Etanercept.
Etanercept ist ein Fusionsprotein des humanen Tumornekrosefaktor-Rezeptors p75 mit Fc, das durch rekombinante DNA-Techniken durch ein Expressionssystem der Ovarienzellen des chinesischen Hamsters (CHO) von Säugetieren gewonnen wird. Etanercept ist ein genetisches Dimer eines chimären Proteins, das durch Fusion der extrazellulären Domäne des humanen Tumornekrosefaktor-Rezeptor-2 (TNFR2/p75), die für die Bindung an den Liganden verantwortlich ist, mit der Fc-Fraktion des humanen IgG1-Immunglobulins. Diese Fc-Fraktion enthält die Hinge-Region, die CH2- und CH3-Regionen, jedoch nicht die CH1-Region von IgG 1. Etanercept enthält 934 Aminosäuren und hat ein scheinbares Molekulargewicht von ungefähr 150 Kilodalton.
Die spezifische Aktivität von Etanercept beträgt 1,7 x 106 Einheiten / mg.
Die vollständige Liste der sonstigen Bestandteile finden Sie in Abschnitt 6.1
03.0 DARREICHUNGSFORM
Injizierbare Lösung.
Die Lösung ist klar und farblos oder blassgelb.
04.0 KLINISCHE INFORMATIONEN
04.1 Anwendungsgebiete
Rheumatoide Arthritis
Enbrel in Kombination mit Methotrexat ist angezeigt zur Behandlung der mittelschweren bis schweren aktiven rheumatoiden Arthritis bei Erwachsenen, wenn das Ansprechen auf krankheitsmodifizierende Antirheumatika einschließlich Methotrexat (sofern nicht kontraindiziert) unzureichend war.
Enbrel kann allein angewendet werden, wenn Methotrexat nicht vertragen wird oder wenn eine kontinuierliche Behandlung mit Methotrexat nicht angebracht ist.
Enbrel ist auch angezeigt zur Behandlung von schwerer, aktiver und fortschreitender rheumatoider Arthritis bei Erwachsenen, die zuvor nicht mit Methotrexat behandelt wurden.
Enbrel allein oder in Kombination mit Methotrexat hat gezeigt, dass es die Progressionsrate von Gelenkschäden, gemessen durch Röntgenbilder, verringert und die körperliche Funktion verbessert.
Psoriasis-Arthritis
Behandlung der aktiven und progressiven Psoriasis-Arthritis bei Erwachsenen, wenn das Ansprechen auf krankheitsmodifizierende Antirheumatika unzureichend war Enbrel verbessert nachweislich die körperliche Funktion bei Patienten mit Psoriasis-Arthritis und verringert die Progressionsrate peripherer Gelenkschäden gemäß Röntgenbefund bei Patienten mit symmetrischen polyartikulären Subtypen der Krankheit.
Spondylitis ankylosans
Behandlung der schweren, aktiven Spondylitis ankylosans bei Erwachsenen, die auf eine konventionelle Therapie unzureichend angesprochen haben.
Plaque-Psoriasis
Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei Erwachsenen, die auf andere systemische Therapien, einschließlich Ciclosporin, Methotrexat oder Psoralen und UV-Licht A (PUVA) nicht angesprochen haben, eine Kontraindikation haben oder diese nicht vertragen (siehe Abschnitt 5.1)
Plaque-Psoriasis bei Kindern
Behandlung der schweren chronischen Plaque-Psoriasis bei Kindern und Jugendlichen ab 6 Jahren, die durch andere systemische Therapien oder Phototherapien nicht ausreichend kontrolliert werden oder diese nicht vertragen.
04.2 Dosierung und Art der Anwendung
Die Behandlung mit Enbrel sollte von einem Facharzt eingeleitet und überwacht werden, der Erfahrung in der Diagnose und Behandlung von rheumatoider Arthritis, Psoriasis-Arthritis, ankylosierender Spondylitis, Plaque-Psoriasis oder Plaque-Psoriasis bei Kindern hat.
Patienten, die mit Enbrel behandelt werden, muss der Patientenpass ausgehändigt werden.
Enbrel ist in den Stärken 10, 25 und 50 mg erhältlich.
Dosierung
Rheumatoide Arthritis
Die empfohlene Dosis beträgt 25 mg Enbrel zweimal wöchentlich. Alternativ hat sich eine einmal wöchentliche Gabe von 50 mg Enbrel als sicher und wirksam erwiesen (siehe Abschnitt 5.1).
Psoriasis-Arthritis und Spondylitis ankylosans
Die empfohlene Dosis beträgt 25 mg Enbrel zweimal wöchentlich oder 50 mg einmal wöchentlich.
Plaque-Psoriasis
Die empfohlene Dosis von Enbrel beträgt 25 mg zweimal wöchentlich oder 50 mg einmal wöchentlich.
Alternativ können 50 mg zweimal wöchentlich für 12 Wochen verwendet werden, gefolgt von einer Dosis von 25 mg zweimal wöchentlich oder 50 mg einmal wöchentlich, falls erforderlich. Die Behandlung mit Enbrel sollte bis zu 24 Wochen lang fortgesetzt werden, bis eine Remission erreicht ist. Bei einigen erwachsenen Patienten kann eine kontinuierliche Therapie über mehr als 24 Wochen angemessen sein (siehe Abschnitt 5.1). Bei Patienten, die nach 12 Wochen kein Ansprechen zeigen, sollte die Behandlung abgebrochen werden.
Wenn erneut eine Behandlung mit Enbrel angezeigt ist, sollten die gleichen Anweisungen zur Behandlungsdauer befolgt werden. Die Dosis sollte zweimal wöchentlich 25 mg oder einmal wöchentlich 50 mg betragen.
Besondere Bevölkerungsgruppen
Nieren- und Leberinsuffizienz
Eine Dosisanpassung ist nicht erforderlich.
Ältere Menschen (≥ 65 Jahre)
Eine Dosisanpassung ist nicht erforderlich. Dosierung und Art der Anwendung sind die gleichen wie bei Erwachsenen zwischen 18 und 64 Jahren.
Kinder und Jugendliche
Die Dosierung von Enbrel für pädiatrische Patienten hängt vom Körpergewicht ab. Patienten mit einem Körpergewicht von weniger als 62,5 kg sollten Enbrel vorsichtig auf mg/kg-Basis mit Enbrel 25 mg/ml Pulver und Lösungsmittel zur Herstellung einer Injektionslösung für Kinder und Jugendliche verabreichen (siehe Dosierungen für einzelne Indikationen unten). Patienten mit einem Gewicht von 62,5 kg oder mehr können sowohl die Fertigspritze als auch den Fertigpen in festen Dosen verwenden.
Plaque-Psoriasis bei Kindern (ab 6 Jahren)
Die empfohlene Dosis beträgt 0,8 mg / kg (bis zu maximal 50 mg pro Dosis) einmal wöchentlich für bis zu 24 Wochen. Bei Patienten, die nach 12 Wochen kein Ansprechen zeigen, sollte die Behandlung abgebrochen werden.
Für den Fall, dass eine Behandlung mit Enbrel erneut angezeigt ist, sollten die obigen Anweisungen zur Behandlungsdauer befolgt werden. Die Dosis sollte einmal wöchentlich 0,8 mg/kg (bis maximal 50 mg pro Dosis) betragen.
Enbrel ist im Allgemeinen nicht für Kinder unter 6 Jahren für die Indikation Plaque-Psoriasis geeignet.
Art der Verabreichung
Enbrel wird durch subkutane Injektion verabreicht.
Detaillierte Anweisungen zur Anwendung finden Sie in der Packungsbeilage, Abschnitt 7, „Anleitung zur Vorbereitung und Verabreichung einer „Enbrel-Injektion“.
04.3 Kontraindikationen
Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Sepsis oder Sepsisrisiko.
Die Behandlung mit Enbrel sollte bei Patienten mit aktiver Infektion, einschließlich chronischer oder lokalisierter Infektionen, nicht begonnen werden.
04.4 Besondere Warnhinweise und geeignete Vorsichtsmaßnahmen für die Anwendung
Infektionen
Die Patienten sollten vor, während und nach der Behandlung mit Enbrel auf Infektionen getestet werden, da die mittlere Halbwertszeit von Etanercept etwa 70 Stunden beträgt (Bereich 7 bis 300 Stunden).
Schwere Infektionen, Sepsis, Tuberkulose und andere opportunistische Infektionen, einschließlich invasiver Pilzinfektionen, wurden bei der Anwendung von Enbrel berichtet (siehe Abschnitt 4.8). Diese Infektionen wurden durch Bakterien, Mykobakterien, Pilze und Viren verursacht. In einigen Fällen durch bestimmte Pilze. oder andere opportunistische Infektionen wurden nicht erkannt, was zu einer Verzögerung der angemessenen Behandlung und in einigen Fällen zum Tod führt. Bei der Untersuchung von Patienten auf Infektionen sollte das Risiko des Patienten für relevante opportunistische Infektionen (z. B. Exposition gegenüber endemischen Mykosen) berücksichtigt werden. ).
Patienten, die während der Behandlung mit Enbrel eine neue Infektion entwickeln, sollten engmaschig überwacht werden. Wenn der Patient eine schwere Infektion entwickelt, sollte die Anwendung von Enbrel abgebrochen werden Die Sicherheit und Wirksamkeit von Enbrel bei Patienten mit chronischen Infektionen wurden nicht untersucht. Ärzte sollten bei der Beurteilung der Anwendung von Enbrel bei Patienten mit wiederkehrenden oder chronischen Infektionen in der Vorgeschichte oder mit Grunderkrankungen, die Patienten für eine Infektion anfällig machen können, sowie mit fortgeschrittenem oder schlecht eingestelltem Diabetes vorsichtig sein.
Tuberkulose
Bei Patienten, die mit Enbrel behandelt wurden, wurde über Fälle von aktiver Tuberkulose einschließlich Miliartuberkulose und Tuberkulose mit extrapulmonaler Lokalisation berichtet.
Vor Beginn der Behandlung mit Enbrel müssen alle Patienten auf aktive und inaktive („latente“) Tuberkulose getestet werden. Diese Abklärung sollte eine ausführliche Anamnese einschließlich der persönlichen Tuberkulose-Anamnese oder möglicher früherer Kontakte mit Tuberkulose und einer früheren und/oder aktuellen immunsuppressiven Therapie beinhalten. Bei allen Patienten sollten geeignete Screening-Tests durchgeführt werden, z. Es wird empfohlen, diese Tests auf der Patientenkarte zu vermerken. Ärzte werden auf das Risiko eines falsch negativen Tuberkulin-Hauttests hingewiesen, insbesondere bei schwerkranken oder immungeschwächten Patienten.
Wenn eine aktive Tuberkulose diagnostiziert wird, darf die Enbrel-Therapie nicht eingeleitet werden. Wenn eine inaktive ("latente") Tuberkulose diagnostiziert wird, sollte die Behandlung der latenten Tuberkulose vor Beginn der Enbrel-Therapie und gemäß den örtlichen Vorschriften mit einer Anti-Tuberkulose-Therapie begonnen werden. In dieser Situation muss das Nutzen-Risiko-Verhältnis bei der Behandlung mit Enbrel sorgfältig abgewogen werden.
Allen Patienten sollte geraten werden, einen Arzt aufzusuchen, wenn während oder nach der Behandlung mit Enbrel Anzeichen/Symptome auftreten, die auf eine Tuberkulose hindeuten (z. B. anhaltender Husten, Auszehrung/Gewichtsverlust, leichtes Fieber).
Reaktivierung des Hepatitis-B-Virus
Bei chronischen Trägern dieses Virus, die Anti-TNFs wie Enbrel erhalten, wurde über eine Reaktivierung des Hepatitis-B-Virus (HBV) berichtet.Patienten mit einem Risiko für eine HBV-Infektion sollten vor der Behandlung einer Voruntersuchung auf eine HBV-Infektion unterzogen werden.Die Therapie mit Enbrel beginnen. Besondere Vorsicht ist bei der Verabreichung von Enbrel an Patienten mit HBV geboten. Wenn Enbrel bei HBV-Trägern angewendet wird, sollten die Patienten auf Anzeichen und Symptome einer aktiven HBV-Infektion überwacht und gegebenenfalls eine geeignete Behandlung eingeleitet werden.
Verschlechterung der Hepatitis C
Bei mit Enbrel behandelten Patienten wurde über eine Verschlechterung der Hepatitis C berichtet. Enbrel sollte bei Patienten mit Hepatitis C in der Vorgeschichte mit Vorsicht angewendet werden.
Gleichzeitige Behandlung mit Anakinra
Die gleichzeitige Anwendung von Enbrel und Anakinra war im Vergleich zur alleinigen Anwendung von Enbrel mit einem erhöhten Risiko für schwere Infektionen und Neutropenie verbunden. Diese Kombination zeigte keinen erhöhten klinischen Nutzen. Daher zeigte die kombinierte Anwendung von Enbrel und Anakinra keine empfohlen (siehe Abschnitte 4.5 und 4.8).
Gleichzeitige Behandlung mit Abatacept
In klinischen Studien führte die gleichzeitige Behandlung mit Abatacept und Enbrel zu einer erhöhten Inzidenz schwerwiegender Nebenwirkungen Diese Kombination zeigte keinen erhöhten klinischen Nutzen, daher wird die Anwendung nicht empfohlen (siehe Abschnitt 4.5).
Allergische Reaktionen
Allergische Reaktionen im Zusammenhang mit der Verabreichung von Enbrel wurden häufig berichtet.
Allergische Reaktionen umfassten Angioödem und Urtikaria; es gab heftige Reaktionen. Wenn eine schwere allergische oder anaphylaktische Reaktion auftritt, sollte die Behandlung mit Enbrel sofort abgebrochen und eine geeignete Therapie eingeleitet werden.
Die Nadelkappe der Fertigspritze enthält Latex (getrockneter Naturkautschuk), das bei der Handhabung oder Verabreichung von Enbrel an Personen mit bekannter oder vermuteter Latexempfindlichkeit Überempfindlichkeitsreaktionen hervorrufen kann.
Immunsuppression
Es besteht die Möglichkeit, dass TNF-Antagonisten, einschließlich Enbrel, die Abwehrkräfte des Wirts gegen Infektionen und Malignome beeinflussen, da TNF Entzündungen vermittelt und zelluläre Immunantworten moduliert.In einer Studie mit 49 erwachsenen Patienten mit rheumatoider Arthritis, die mit Enbrel behandelt wurden, gab es keine Hinweise auf eine Depression der Hypersensitivität vom Spättyp, erniedrigte Immunglobulinspiegel oder Veränderungen in der Anzahl der Effektorzellpopulationen.
Zwei Patienten mit juveniler idiopathischer Arthritis entwickelten eine Windpockeninfektion und Anzeichen und Symptome einer aseptischen Meningitis, die ohne Folgeerscheinungen verschwanden. Patienten mit einer signifikanten Exposition gegenüber dem Varicella-Virus sollten die Enbrel-Therapie vorübergehend abbrechen und eine prophylaktische Behandlung mit Varicella-Zoster-Immunglobulin in Erwägung ziehen.
Die Sicherheit und Wirksamkeit von Enbrel bei Patienten mit Immunsuppression wurden nicht untersucht.
Lymphoproliferative Erkrankungen und bösartige Tumoren
Solide und hämatopoetische Malignome (außer Hautkrebs)
Nach der Markteinführung wurde über die Entwicklung von Malignomen (einschließlich Brust- und Lungenkrebs und Lymphomen) berichtet (siehe Abschnitt 4.8).
In klinischen Studien mit Anti-TNF-Medikamenten mit der Kontrollgruppe wurden bei Patienten, die ein Anti-TNF-Medikament erhielten, mehr Fälle von Lymphomen beobachtet als in der Kontrollgruppe. Allerdings waren Fälle selten und der Beobachtungszeitraum für mit Placebo behandelte Patienten war kürzer als für mit TNF behandelte Patienten. Seit der Markteinführung wurden Fälle von Leukämie bei Patienten berichtet, die mit Anti-TNF-Medikamenten behandelt wurden.Bei Patienten mit rheumatoider Arthritis mit lang anhaltender und schwer aktiver entzündlicher Erkrankung besteht ein erhöhtes zugrunde liegendes Risiko für Lymphome und Leukämie, was die Risikoabschätzung erschwert.
Nach derzeitigem Kenntnisstand kann die Entwicklung von Lymphomen, Leukämien oder anderen soliden oder hämatopoetischen Malignomen bei Patienten, die mit Anti-TNF-Medikamenten behandelt werden, nicht ausgeschlossen werden. Vorsicht ist geboten, wenn eine medikamentöse Anti-TNF-Therapie bei Patienten mit einer Malignität in der Vorgeschichte oder eine Fortsetzung der Therapie bei Patienten, die eine Malignität entwickeln, in Betracht gezogen wird.
Bei Kindern, Jugendlichen und jungen Erwachsenen (bis 22 Jahre), die mit Anti-TNF-Medikamenten behandelt wurden, wurde über bösartige Tumoren, manchmal mit tödlichem Ausgang, berichtet (Beginn der Therapie).
Hauttumore
Melanome und nicht-melanozytäre Hautkrebse (NMSCs) wurden bei Patienten berichtet, die mit TNF-Antagonisten, einschließlich Enbrel, behandelt wurden. Nach Markteinführung wurde sehr selten über Fälle von Merkelzellkarzinom bei mit Enbrel behandelten Patienten berichtet.Regelmäßige Hautuntersuchungen werden für alle Patienten empfohlen, insbesondere für Patienten mit Risikofaktoren für die Entwicklung von Hautkrebs.
Kombiniert man die Ergebnisse kontrollierter klinischer Studien, wurden bei Patienten, die mit Enbrel behandelt wurden, mehr Fälle von NMSC beobachtet als bei Kontrollpatienten, insbesondere bei Patienten mit Psoriasis.
Impfungen
Lebendimpfstoffe sollten nicht gleichzeitig mit Enbrel verabreicht werden. Es liegen keine Daten zur sekundären Übertragung von Infektionen durch Lebendimpfstoffe bei Patienten vor, die Enbrel erhalten. In einer randomisierten, doppelblinden, placebokontrollierten klinischen Studie mit erwachsenen Patienten mit Psoriasis-Arthritis erhielten 184 Patienten in Woche 4 auch einen multivalenten Polysaccharid-Impfstoff gegen Pneumokokken B-Zell-Immunantwort auf den Pneumokokken-Polysaccharid-Impfstoff, aber der Titer im Pool war moderat niedriger und nur wenige Patienten zeigten einen doppelten Titeranstieg im Vergleich zu Patienten, die kein Enbrel erhielten.
Die klinische Bedeutung davon ist unbekannt.
Bildung von Autoantikörpern
Die Behandlung mit Enbrel kann zur Bildung von Autoimmunantikörpern führen (siehe Abschnitt 4.8).
Hämatologische Reaktionen
Bei mit Enbrel behandelten Patienten wurden seltene Fälle von Panzytopenie und sehr seltene Fälle von aplastischer Anämie, einige mit tödlichem Ausgang, berichtet. Vorsicht ist geboten bei Patienten, die mit Enbrel behandelt werden und eine „Anamnese von Blutdyskrasien haben Blutergüsse, Blutergüsse, Blutungen, Blässe) während der Einnahme von Enbrel sollten sofort einen Arzt aufsuchen.
Neurologische Pathologien
Es gibt seltene Berichte über demyelinisierende ZNS-Erkrankungen bei mit Enbrel behandelten Patienten (siehe Abschnitt 4.8). Darüber hinaus gab es sehr seltene Berichte über periphere demyelinisierende Polyneuropathien (einschließlich Guillain-Barré-Syndrom, chronisch-entzündliche demyelinisierende Polyneuropathie, demyelinisierende Polyneuropathie und multifokale motorische Neuropathie). Obwohl keine klinischen Studien zur Bewertung der Enbrel-Therapie bei Multiple-Sklerose-Patienten durchgeführt wurden, zeigten klinische Studien bei Multiple-Sklerose-Patienten, die mit anderen TNF-Antagonisten behandelt wurden, eine erhöhte Krankheitsaktivität.
Eine sorgfältige Risiko-Nutzen-Abwägung, einschließlich einer neurologischen Bewertung, wird empfohlen, wenn Enbrel Patienten mit vorbestehender oder kürzlich aufgetretener demyelinisierender Erkrankung oder Patienten mit einem hohen Risiko für die Entwicklung einer demyelinisierenden Erkrankung verschrieben wird.
Kombinierte Therapie
In einer zweijährigen kontrollierten klinischen Studie bei Patienten mit rheumatoider Arthritis führte die Kombination von Enbrel und Methotrexat zu keinen unerwarteten Sicherheitsergebnissen und das Sicherheitsprofil von Enbrel in Kombination mit Methotrexat war dem Profil ähnlich Methotrexat allein gegeben. Langzeitstudien zur Kombinationstherapie sind im Gange.
Die Langzeitsicherheit von Enbrel in Kombination mit anderen krankheitsmodifizierenden Antirheumatika (DMARDs) wurde nicht untersucht.
Bei der Behandlung von Psoriasis wurde die Anwendung von Enbrel in Kombination mit anderen systemischen Therapien oder Phototherapie nicht untersucht.
Nieren- und Leberinsuffizienz
Basierend auf pharmakokinetischen Daten (siehe Abschnitt 5.2) ist bei Patienten mit eingeschränkter Nieren- oder Leberfunktion keine Dosisanpassung erforderlich; klinische Daten zu diesen Patienten sind begrenzt.
Herzinsuffizienz
Ärzte sollten bei der Anwendung von Enbrel bei Patienten mit kongestiver Herzinsuffizienz vorsichtig sein (Kongestive Herzinsuffizienz, CHF). Nach der Markteinführung liegen Berichte über eine Verschlechterung der CHF mit und ohne identifizierbare auslösende Faktoren bei Patienten vor, die mit Enbrel behandelt wurden. Zwei große klinische Studien, in denen die Anwendung von Enbrel bei der Behandlung von CHF untersucht wurde, wurden aufgrund mangelnder Wirksamkeit vorzeitig abgebrochen. Obwohl nicht schlüssig, deuten einige Daten aus einer dieser Studien auf einen möglichen Trend zur Verschlechterung der CHF bei den Patienten hin, die einer Behandlung zugewiesen wurden .
Alkoholische Hepatitis
In einer randomisierten, placebokontrollierten Phase-II-Studie mit 48 hospitalisierten Patienten, die wegen mittelschwerer bis schwerer alkoholischer Hepatitis mit Enbrel oder Placebo behandelt wurden, war Enbrel nicht wirksam und nach 6 Monaten war die Sterblichkeitsrate der mit Enbrel behandelten Patienten signifikant höher. Daher sollte Enbrel bei Patienten mit alkoholischer Hepatitis nicht angewendet werden. Ärzte sollten bei der Anwendung von Enbrel bei Patienten mit mittelschwerer bis schwerer alkoholischer Hepatitis vorsichtig sein.
Wegener-Granulomatose
In einer placebokontrollierten Studie, in der 89 erwachsene Patienten zusätzlich zur Standardtherapie (die Cyclophosphamid oder Methotrexat und Glukokortikoide umfasste) über eine durchschnittliche Dauer von 25 Monaten mit Enbrel behandelt wurden, erwies sich Enbrel als keine wirksame Behandlung der Granulomatose. von Wegener. Die Inzidenz nicht-kutaner Malignome verschiedener Art war bei mit Enbrel behandelten Patienten signifikant höher als in der Kontrollgruppe.Enbrel wird zur Behandlung der Wegener-Granulomatose nicht empfohlen.
Hypoglykämie bei Patienten, die wegen Diabetes behandelt werden
Nach Beginn der Enbrel-Therapie bei Patienten, die Diabetes-Arzneimittel erhielten, wurde bei einigen dieser Patienten über Hypoglykämien berichtet, die eine Reduzierung des Arzneimittels gegen Diabetes erforderlich machten.
Besondere Bevölkerungsgruppen
Ältere Patienten (≥ 65 Jahre)
In den Phase-3-Studien zu rheumatoider Arthritis, Psoriasis-Arthritis und ankylosierender Spondylitis gab es insgesamt keine Unterschiede beim Auftreten von unerwünschten Ereignissen, schwerwiegenden unerwünschten Ereignissen und schweren Infektionen zwischen Patienten ab 65 Jahren und jüngeren Patienten. Ältere Patienten sind jedoch mit Vorsicht zu behandeln und besondere Aufmerksamkeit sollte dem Auftreten von Infektionen geschenkt werden.
Kinder und Jugendliche
Impfungen
Es wird empfohlen, dass pädiatrische Patienten vor Beginn der Therapie mit Enbrel möglichst alle Impfungen gemäß den aktuellen Impfrichtlinien abgeschlossen haben (siehe oben Impfungen).
Entzündliche Darmerkrankung (Entzündliche Darmerkrankung, CED) bei Patienten mit juveniler idiopathischer Arthritis (Juvenile idiopathische Arthritis, JIA)
Bei JIA-Patienten, die mit Enbrel behandelt wurden, wurden Fälle von CED berichtet (siehe Abschnitt 4.8).
04.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Gleichzeitige Behandlung mit Anakinra
Bei erwachsenen Patienten, die mit Enbrel und Anakinra behandelt wurden, wurde eine höhere Inzidenz schwerwiegender Infektionen beobachtet als bei Patienten, die separat entweder mit Enbrel oder Anakinra behandelt wurden (historische Daten). Darüber hinaus wiesen in einer doppelblinden, placebokontrollierten klinischen Studie bei erwachsenen Patienten, die bereits Methotrexat erhielten, mit Enbrel und Anakinra behandelte Patienten eine höhere Inzidenz schwerer Infektionen (7 %) und Neutropenie auf als Patienten, die mit Enbrel behandelt wurden (siehe Abschnitte 4.4 und 4.8). ). Die Kombination von Enbrel und Anakinra hat keinen erhöhten klinischen Nutzen gezeigt und wird daher nicht empfohlen.
Gleichzeitige Behandlung mit Abatacept
In klinischen Studien führte die gleichzeitige Behandlung mit Abatacept und Enbrel zu einer erhöhten Inzidenz schwerwiegender unerwünschter Ereignisse Diese Kombination zeigte keinen erhöhten klinischen Nutzen, daher wird die Anwendung nicht empfohlen (siehe Abschnitt 4.4).
Gleichzeitige Behandlung mit Sulfasalazin
In einer klinischen Studie mit erwachsenen Patienten, die etablierte Dosen von Sulfasalazin erhielten, zu denen Enbrel hinzugefügt wurde, kam es bei Patienten in der Kombinationsgruppe zu einer statistisch signifikanten Abnahme der mittleren Anzahl weißer Blutkörperchen im Vergleich zu den Gruppen, die nur mit Enbrel oder nur mit Sulfasalazin behandelt wurden. Die klinische Bedeutung dieser Wechselwirkung ist unbekannt. Ärzte sollten vorsichtig sein, wenn sie eine Kombinationstherapie mit Sulfasalazin in Betracht ziehen.
Keine Interaktionen
In klinischen Studien wurden keine Wechselwirkungen beobachtet, wenn Enbrel mit Glukokortikoiden, Salicylaten (außer Sulfasalazin), nichtsteroidalen Antirheumatika (NSAIDs), Analgetika oder Methotrexat verabreicht wurde. Siehe Abschnitt 4.4 für Impfwarnungen.
In Studien mit Digoxin oder Warfarin wurden keine signifikanten pharmakokinetischen Arzneimittelwechselwirkungen beobachtet.
04.6 Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten darauf hingewiesen werden, dass während und bis zu drei Wochen nach Beendigung der Behandlung mit Enbrel geeignete empfängnisverhütende Maßnahmen ergriffen werden müssen, um eine Schwangerschaft zu vermeiden.
Schwangerschaft
Entwicklungstoxizitätsstudien an Ratten und Kaninchen ergaben keine Hinweise auf eine Schädigung des Fötus oder der neugeborenen Ratte durch Etanercept. Es liegen keine Studien mit Enbrel bei schwangeren Frauen vor. Daher wird Enbrel während der Schwangerschaft nicht empfohlen.
Fütterungszeit
Es ist nicht bekannt, ob Enbrel in die Muttermilch übergeht. Nach subkutaner Verabreichung an säugende Ratten wurde Etanercept in die Muttermilch ausgeschieden und im Serum der Jungtiere wiedergefunden.
Da Immunglobuline wie viele andere Arzneimittel in die Muttermilch übergehen können, muss unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Therapie bei die frau. .
Fruchtbarkeit
Es liegen keine präklinischen Daten zur peri- und postnatalen Toxizität von Etanercept und zu den Auswirkungen von Etanercept auf die Fertilität und die allgemeine Reproduktionsleistung vor.
04.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zur Verkehrstüchtigkeit und zum Bedienen von Maschinen durchgeführt.
04.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die am häufigsten berichteten Nebenwirkungen sind Reaktionen an der Injektionsstelle (wie Schmerzen, Schwellungen, Juckreiz, Rötung und Blutung an der Injektionsstelle), Infektionen (wie Infektionen der oberen Atemwege, Bronchitis, Blasenentzündungen und Hautinfektionen), allergische Reaktionen, Entwicklung von Antikörpern, Juckreiz und Fieber.
Auch unter Enbrel wurden schwerwiegende Nebenwirkungen berichtet. TNF-Antagonisten wie Enbrel beeinträchtigen das Immunsystem und ihre Anwendung kann die Abwehrkräfte des Körpers gegen Infektionen und Krebs beeinträchtigen. Schwere Infektionen wurden bei weniger als 1 von 100 mit Enbrel behandelten Patienten festgestellt. Berichtet wurden auch Fälle von Sepsis und Infektionen mit a tödlicher oder lebensbedrohlicher Ausgang Es wurde über verschiedene bösartige Erkrankungen im Zusammenhang mit der Anwendung von Enbrel berichtet, einschließlich Brust-, Lungen-, Haut- und Lymphdrüsenkrebs (Lymphom).
Schwere hämatologische, neurologische und Autoimmunreaktionen wurden ebenfalls berichtet. Zu diesen Reaktionen gehören die seltenen Fallberichte von Panzytopenie und die sehr seltenen Fallberichte von aplastischer Anämie. Zentrale und periphere Demyelinisierungsereignisse wurden selten bzw. sehr selten unter der Anwendung von Enbrel berichtet Es gab Berichte über Lupus, Lupus-assoziierte Erkrankungen und Vaskulitis.
Liste der Nebenwirkungen
Die folgende Liste der Nebenwirkungen basiert auf Erfahrungen aus klinischen Studien bei Erwachsenen und Erfahrungen nach der Markteinführung.
Innerhalb der Systemorganklasse sind die Nebenwirkungen nach Häufigkeitsklassen (vermutete Anzahl der Patienten mit dieser Reaktion) in den folgenden Kategorien aufgeführt: sehr häufig (≥ 1/10), häufig (≥ 1/100,
Infektionen und parasitäre Erkrankungen:
Sehr häufig: Infektionen (einschließlich Infektionen der oberen Atemwege, Bronchitis, Blasenentzündung, Hautinfektionen) *
Gelegentlich: schwere Infektionen (einschließlich Lungenentzündung, Zellulitis, septische Arthritis, Sepsis) *
Selten: Tuberkulose, opportunistische Infektionen (einschließlich invasiver Pilz-, Protozoen-, bakterieller und atypischer mykobakterieller Infektionen).
Gutartige, bösartige und unspezifische Neubildungen (einschließlich Zysten und Polypen):
Gelegentlich: Nicht-melanozytärer Hautkrebs * (siehe Abschnitt 4.4)
Selten: Lymphom, Melanom (siehe Abschnitt 4.4)
nicht bekannt: Leukämie, Merkelzellkarzinom (siehe Abschnitt 4.4)
Erkrankungen des Blut- und Lymphsystems:
Gelegentlich: Thrombozytopenie
Selten: Anämie, Leukopenie, Neutropenie, Panzytopenie *
Sehr selten: aplastische Anämie *
Störungen des Immunsystems:
Häufig: allergische Reaktionen (siehe Erkrankungen der Haut und des Unterhautzellgewebes), Bildung von Autoantikörpern *
Gelegentlich: systemische Vaskulitis (einschließlich Vaskulitis in Verbindung mit antineutrophilen zytoplasmatischen Antikörpern)
Selten: schwere allergische und anaphylaktische Reaktionen (einschließlich Angioödem und Bronchospasmus), Sarkoidose
Nicht bekannt: Makrophagenaktivierungssyndrom *
Erkrankungen des Nervensystems:
Selten: Krämpfe,
Episoden einer ZNS-Demyelinisierung, die auf Multiple Sklerose hinweisen, oder lokalisierte Demyelinisierungssituationen wie Optikusneuritis und transversale Myelitis (siehe Abschnitt 4.4)
Sehr selten: Periphere Demyelinisierungsereignisse, einschließlich Guillain-Barré-Syndrom, chronisch-entzündliche demyelinisierende Polyneuropathie, demyelinisierende Polyneuropathie und multifokale motorische Neuropathie (siehe Abschnitt 4.4)
Augenerkrankungen:
Gelegentlich: Uveitis
Herzerkrankungen:
Selten: Verschlechterung einer kongestiven Herzinsuffizienz (siehe Abschnitt 4.4)
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Gelegentlich: interstitielle Lungenerkrankung (einschließlich Pneumonie und Lungenfibrose) *
Leber- und Gallenerkrankungen:
Selten: erhöhte Leberenzyme, Autoimmunhepatitis
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig: Juckreiz
Gelegentlich: Angioödem, Urtikaria-Ausschlag, psoriasiformer Ausschlag, Psoriasis (einschließlich Neubeginn oder Verschlechterung und Pusteln, hauptsächlich Handflächen und Fußsohlen)
Selten: kutane Vaskulitis (einschließlich leukozytoklastischer Vaskulitis), Steven-Johnson-Syndrom, Erythema multiforme
Sehr selten: toxische epidermale Nekrolyse
Muskel-Skelett- und Bindegewebserkrankungen:
Selten: Subakuter kutaner Lupus erythematodes, diskoider Lupus erythematodes, lupusähnliches Syndrom
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: Reaktionen an der Injektionsstelle (einschließlich Blutungen, Blutergüsse, Erytheme, Juckreiz, Schmerzen, Schwellungen) *
Häufig: Fieber
* siehe „Beschreibung ausgewählter Nebenwirkungen“ unten.
Beschreibung ausgewählter Nebenwirkungen
Bösartige Tumoren und lymphoproliferative Erkrankungen
Einhundertneunundzwanzig neue Malignome verschiedener Art. Die in diesen klinischen Studien beobachtete Häufigkeit und Inzidenz entsprach denen, die für die untersuchte Population erwartet wurden.
In klinischen Studien mit einer Dauer von etwa 2 Jahren an 240 Patienten mit Psoriasis-Arthritis, die mit Enbrel behandelt wurden, wurden insgesamt 2 maligne Erkrankungen berichtet. In klinischen Studien, die über mehr als zwei Jahre an 351 Patienten mit ankylosierender Spondylitis durchgeführt wurden, wurde bei mit Enbrel behandelten Patienten über 6 maligne Erkrankungen berichtet.
In einer Gruppe von 2.711 Patienten mit Plaque-Psoriasis, die in Doppelblind- und Open-Label-Studien mit einer Dauer von bis zu 2,5 Jahren mit Enbrel behandelt wurden, wurden 30 maligne Erkrankungen und 43 nicht-melanozytäre Hautkrebsarten berichtet.
In klinischen Studien zu rheumatoider Arthritis, Psoriasis-Arthritis, ankylosierender Spondylitis und Psoriasis wurden 18 Lymphome bei einer Gruppe von 7.416 Patienten berichtet, die mit Enbrel behandelt wurden.
Berichte über verschiedene bösartige Erkrankungen (einschließlich Brust- und Lungenkarzinom sowie Lymphome) sind auch nach der Markteinführung eingegangen (siehe Abschnitt 4.4).
Reaktionen an der Injektionsstelle
Im Vergleich zu Placebo traten bei Patienten mit rheumatischen Erkrankungen, die mit Enbrel behandelt wurden, signifikant häufiger Reaktionen an der Injektionsstelle auf (36 % gegenüber 9 %). Reaktionen an der Injektionsstelle traten normalerweise im ersten Monat auf. Die durchschnittliche Dauer lag zwischen etwa 3 und 5 Tagen. Die meisten der Reaktionen an der Injektionsstelle, die in den Gruppen auftraten, die Enbrel erhielten, waren unbehandelt, während die Mehrheit der Patienten, die eine Therapie erhielten, topische Präparate wie Kortikosteroide erhielten.Zusätzlich entwickelten einige Patienten Booster-Reaktionen an der Injektionsstelle, die durch eine Hautreaktion bei der letzten Injektion gekennzeichnet waren an der Injektionsstelle, zusammen mit einem gleichzeitigen Auftreten von Reaktionen an der Injektionsstelle von früheren Injektionsstellen.In der Regel waren diese Reaktionen vorübergehend und traten während der Behandlung nicht wieder auf.
Während der ersten 12 Behandlungswochen in kontrollierten klinischen Studien bei Patienten mit Plaque-Psoriasis entwickelten etwa 13,6 % der mit Enbrel behandelten Patienten Reaktionen an der Injektionsstelle im Vergleich zu 3,4 % der mit Placebo behandelten Patienten.
Schwere Infektionen
In placebokontrollierten Studien wurde kein Anstieg der Inzidenz schwerwiegender Infektionen (tödlich, lebensbedrohlich oder die einen Krankenhausaufenthalt oder eine intravenöse Antibiotikagabe erforderlich machen) beobachtet. Schwere Infektionen traten bei 6,3 % der Patienten mit rheumatoider Arthritis auf, die bis zu 48 Monate mit Enbrel behandelt wurden Abszess (an verschiedenen Stellen), Bakteriämie, Bronchitis, Schleimbeutelentzündung, Cellulitis, Cholezystitis, Durchfall, Divertikulitis, Endokarditis (Verdacht), Gastroenteritis, Hepatitis B Herpes Zoster, Ulcus cruris, Mundinfektion, Otitis, Osteomyelitis, Peritonitis, Pneumonie, Pysisoneph , septische Arthritis, Sinusitis, Hautinfektionen, Hautgeschwüre, Harnwegsinfektionen, Vaskulitis und Wundinfektionen In der zweijährigen aktiv kontrollierten klinischen Studie, in der Patienten mit Enbrel allein oder mit Methotrexat allein oder mit Enbrel in Kombination mit Methotrexat behandelt wurden die Rate schwerer Infektionen war zwischen den drei Gruppen ähnlich. attati. Es kann jedoch nicht ausgeschlossen werden, dass die Kombination von Enbrel mit Methotrexat mit einer erhöhten Infektionsrate verbunden sein könnte.
In placebokontrollierten klinischen Studien mit einer Dauer von bis zu 24 Wochen gab es keine Unterschiede in der Inzidenz von Infektionen zwischen Patienten, die mit Enbrel und denen mit Placebo wegen Plaque-Psoriasis behandelt wurden.Schwere Infektionen einschließlich Cellulitis, Gastroenteritis, Lungenentzündung wurden berichtet , Gastritis, Appendizitis, Streptokokkenfasziitis, Myositis, septischer Schock, Divertikulitis und Abszesse bei mit Enbrel behandelten Patienten In den doppelblinden und offenen Studien zur Psoriasis-Arthritis berichtete 1 Patient über eine schwere Infektion (Pneumonie).
Während der Anwendung von Enbrel wurde über schwerwiegende und tödliche Infektionen berichtet; zu den gefundenen Krankheitserregern gehören Bakterien, Mykobakterien (einschließlich Tuberkulose), Viren und Pilze. Einige traten innerhalb weniger Wochen nach Beginn der Behandlung mit Enbrel bei Patienten auf, bei denen Prädisponsoren (z. B. Diabetes, kongestive Herzinsuffizienz, aktuelle oder chronische Infektionen in der Vorgeschichte) zusätzlich zu ihrer rheumatoiden Arthritis (siehe Abschnitt 4.4). Die Behandlung mit Enbrel kann die Mortalität bei Patienten mit diagnostizierter Sepsis erhöhen.
Im Zusammenhang mit Enbrel wurde über opportunistische Infektionen berichtet, einschließlich invasiver Pilze, Protozoen, Bakterien (einschließlich Listerien Und Legionellen) und atypische Mykobakterien. In einem Datensatz aus klinischen Studien betrug die Gesamtinzidenz opportunistischer Infektionen 0,09 % bei 15.402 Patienten, die Enbrel erhielten, die expositionsbereinigte Rate betrug 0,06 Ereignisse pro 100 Patienten. Nach der Markteinführung stellten etwa die Hälfte aller Fälle globaler opportunistischer Infektionen invasive Pilzinfektionen dar. Die am häufigsten gemeldeten invasiven Pilzinfektionen stammten von Pneumozystis Und Aspergillus. Invasive Pilzinfektionen machen mehr als die Hälfte der tödlichen Ereignisse bei Patienten aus, die opportunistische Infektionen entwickelt haben. Die meisten Fälle mit tödlichem Ausgang traten bei Patienten mit Lungenentzündung auf Pneumozystis, unspezifische systemische Pilzinfektionen und Aspergillose (siehe Abschnitt 4.4).
Autoantikörper
Serumproben von erwachsenen Patienten wurden zu verschiedenen Zeitpunkten auf Autoantikörper getestet. Unter den Patienten mit rheumatoider Arthritis, die auf antinukleäre Antikörper (ANA) getestet wurden, war der Anteil der Patienten, die eine neue positive ANA entwickelten (≥ 1:40), bei den mit Enbrel behandelten Patienten (11 %) höher als bei den mit Placebo behandelten Patienten (5 %). Der Prozentsatz der Patienten, die einen neuen positiven DNA-Doppelhelix-Antikörper entwickelten, war im Radioimmunoassay noch höher (15% der mit Enbrel behandelten Patienten gegenüber 4% der mit Placebo behandelten Patienten) und im Test Crithidia luciliae (3 % der mit Enbrel behandelten Patienten im Vergleich zu keinem der mit Placebo behandelten Patienten). Der Prozentsatz der mit Enbrel behandelten Patienten, die Anticardiolipin-Antikörper entwickelten, stieg ähnlich an wie bei den mit Placebo behandelten Patienten. Die Auswirkungen einer Langzeitbehandlung mit Enbrel auf die Entwicklung von Autoimmunerkrankungen sind nicht bekannt.
Bei einigen Patienten, einschließlich Patienten mit positivem Rheumafaktor, wurde selten über die Entwicklung anderer Autoantikörper in Verbindung mit einem Lupus-ähnlichen Syndrom oder klinisch und biopsisch verträglichen Hautreaktionen mit subakutem kutanem Lupus oder Lupus berichtet.
Panzytopenie und aplastische Anämie
Nach der Markteinführung gab es Berichte über Panzytopenie und aplastische Anämie, von denen einige tödlich verliefen (siehe Abschnitt 4.4).
Interstitielle Lungenerkrankungen
Nach der Markteinführung gab es Berichte über interstitielle Lungenerkrankungen (einschließlich Pneumonie und Lungenfibrose), von denen einige tödlich verliefen.
Gleichzeitige Behandlung mit Anakinra
In Studien, in denen erwachsene Patienten gleichzeitig mit Enbrel plus Anakinra behandelt wurden, wurde eine „höhere Inzidenz schwerwiegender Infektionen als mit Enbrel allein beobachtet und 2 % der Patienten (3/139) entwickelten eine Neutropenie (absolute Neutrophilenzahl 3). Ein neutropenischer Patient entwickelte eine Cellulitis, die nach Krankenhausaufenthalt behoben (siehe Abschnitte 4.4 und 4.5).
Kinder und Jugendliche
Nebenwirkungen bei pädiatrischen Patienten mit Plaque-Psoriasis
In einer 48-wöchigen Studie mit 211 Kindern im Alter von 4 bis 17 Jahren mit pädiatrischer Plaque-Psoriasis waren die berichteten Nebenwirkungen ähnlich wie in früheren Studien bei Erwachsenen mit Plaque-Psoriasis.
In klinischen Studien zur juvenilen idiopathischen Arthritis wurden vier Fälle von Makrophagenaktivierungssyndrom berichtet.
Nach Markteinführung gab es Fälle von entzündlichen Darmerkrankungen bei JIA-Patienten, die mit Enbrel behandelt wurden, einschließlich einer sehr begrenzten Anzahl von Fällen mit positiver Reexposition (siehe Abschnitt 4.4).
04.9 Überdosierung
In klinischen Studien bei Patienten mit rheumatoider Arthritis wurden keine grenzwertigen Toxizitätsdosen beobachtet. Die höchste bewertete Dosis war eine intravenöse Aufsättigungsdosis von 32 mg/m2 gefolgt von einer subkutanen Dosis von 16 mg/m2, die zweimal wöchentlich verabreicht wurde. Ein Patient mit rheumatoider Arthritis verabreichte sich irrtümlicherweise zweimal wöchentlich 62 mg Enbrel subkutan über einen Zeitraum von 3 Wochen, ohne dass Nebenwirkungen auftraten. Das Gegenmittel für Enbrel ist unbekannt.
05.0 PHARMAKOLOGISCHE EIGENSCHAFTEN
05.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Immunsuppressiva, Tumornekrosefaktor-α (TNF-α)-Inhibitoren ATC-Code: L04AB01
Tumornekrosefaktor (TNF) stellt ein vorherrschendes Zytokin im Entzündungsprozess der rheumatoiden Arthritis dar. Erhöhte TNF-Spiegel wurden auch in Synovial- und Psoriasis-Plaques von Patienten mit Psoriasis-Arthritis sowie im Serum und Synovialgewebe von Patienten mit Spondylitis gefunden .
Bei Plaque-Psoriasis führt die Infiltration von Entzündungszellen, einschließlich T-Zellen, zu einem Anstieg der TNF-Spiegel in psoriatischen Läsionen im Vergleich zu den Spiegeln in nicht betroffener Haut. Etanercept ist ein kompetitiver Inhibitor der TNF-Bindung an seine Zellrezeptoren von TNF.
TNF und Lymphotoxin sind proinflammatorische Zytokine, die an zwei verschiedene Zelloberflächenrezeptoren binden: die 55 Kilodalton (p55) und 75 Kilodalton (p75) Tumornekrosefaktor-(TNFR)-Rezeptoren. Beide TNFRs kommen von Natur aus in membrangebundener und löslicher Form vor. Von TNFRs in löslicher Form wird angenommen, dass sie die biologische Aktivität von TNF regulieren.
TNF und Lymphotoxin existieren überwiegend als Homotrimere, wobei ihre biologische Aktivität von der Quervernetzung mit Zelloberflächen-TNFRs abhängt. Lösliche dimere Rezeptoren wie Etanercept haben eine höhere Bindungsaffinität für TNF als monomere Rezeptoren und stellen deutlich wirksamere kompetitive Inhibitoren der TNF-Bindung an die eigenen Zellrezeptoren dar. Immunglobulin Fc als Fusionselement beim Aufbau eines dimeren Rezeptors verleiht a längere Plasmahalbwertszeit.
Wirkmechanismus
Die meisten Gelenkerkrankungen bei rheumatoider Arthritis und ankylosierender Spondylitis sowie Hauterkrankungen bei Plaque-Psoriasis werden durch proinflammatorische Moleküle vermittelt, die in einem TNF-kontrollierten Netzwerk verbunden sind.Der Wirkmechanismus von Etanercept besteht vermutlich in einer kompetitiven Hemmung von die Bindung von TNF an TNFR-Oberflächenrezeptoren, die durch TNF vermittelte zelluläre Reaktionen verhindert, indem TNF biologisch inaktiv gemacht wird. Etanercept kann auch biologische Reaktionen modulieren, die durch zusätzliche Kaskadenmoleküle (z .
Klinische Wirksamkeit und Sicherheit
Dieser Abschnitt präsentiert Daten aus vier randomisierten kontrollierten klinischen Studien mit Erwachsenen mit rheumatoider Arthritis, einer Studie mit Erwachsenen mit Psoriasis-Arthritis, einer Studie mit Erwachsenen mit ankylosierender Spondylitis, vier Studien mit Erwachsenen mit Plaque-Psoriasis und einer Studie mit pädiatrischen Patienten mit Psoriasis .
Erwachsene Patienten mit rheumatoider Arthritis
Die Wirksamkeit von Enbrel wurde in einer randomisierten, doppelblinden, placebokontrollierten Studie an 234 erwachsenen Patienten mit aktiver rheumatoider Arthritis untersucht, die auf eine Therapie mit mindestens einem, aber nicht mehr von vier krankheitsmodifizierenden Antirheumatika . nicht angesprochen hatten Medikamente (DMARDs). Dosen von 10 mg oder 25 mg Enbrel oder Placebo wurden 6 aufeinanderfolgende Monate lang zweimal wöchentlich subkutan verabreicht. Die Ergebnisse dieser kontrollierten klinischen Studie wurden als Prozentsatz der Verbesserung der rheumatoiden Arthritis unter Verwendung des American College of Rheumatology ( ACR) Ansprechkriterium: ACR 20 und 50 waren bei Patienten, die mit Enbrel nach 3 und 6 Monaten behandelt wurden, stärker als bei Patienten, die mit Placebo behandelt wurden (ACR 20: Enbrel 62 % und 59 %, Placebo 23 % und 11 % nach drei und 6 Monaten jeweils: ACR 50: Enbrel 41 % und 40 %, Placebo 8 % bzw. 5 % nach drei bzw. sechs Monaten; p
Ungefähr 15 % der Patienten, die Enbrel erhielten, erreichten in Monat 3 und 6 ein Ansprechen mit ACR 70, verglichen mit weniger als 5 % der Patienten im Placebo-Arm. Bei Patienten, die Enbrel erhielten, wurde ein klinisches Ansprechen im Allgemeinen zwischen 1 und 2 Wochen nach Beginn der Therapie beobachtet und traten fast alle innerhalb von 3 Monaten auf.Es wurde eine Dosisreaktion beobachtet: Die mit 10 mg erhaltenen Ergebnisse sind Zwischenzustände zwischen Placebo und 25 mg signifikant besser als Placebo in allen Parametern der ACR-Kriterien sowie in anderen Bewertungen der Krankheitsaktivität der rheumatoiden Arthritis, die nicht in den ACR-Ansprechkriterien enthalten sind, wie beispielsweise Morgensteifigkeit Monate während der Studie, die Behinderung, Vitalität, psychische Gesundheit, allgemeine Gesundheitszustände und Unterdomänen in Bezug auf Arthritis-bedingte Gesundheitszustände umfasste. Alle HAQ-Unterdomänen verbesserten sich bei mit Enbrel behandelten Patienten im Vergleich zu den Kontrollen nach 3 und 6 Monaten.
Nach dem Absetzen von Enbrel kehren die Arthritis-Symptome normalerweise innerhalb eines Monats zurück.
Die Wiederaufnahme der Behandlung mit Enbrel nach einer Unterbrechung von bis zu 24 Monaten führt basierend auf den Ergebnissen der offenen Studien zu einem vergleichbaren Ansprechen wie bei Patienten, die Enbrel ohne Unterbrechung der Therapie erhielten. Dauerhaftes Ansprechen, das bis zu 48 Monate lang anhielt, wurde bei der Verlängerung der Therapie in offenen klinischen Studien beobachtet, wenn Patienten Enbrel ohne Unterbrechung erhielten; längerfristige Erfahrungen liegen nicht vor.
Die Wirksamkeit von Enbrel wurde mit Methotrexat in einer dritten, randomisierten, aktiv kontrollierten Studie mit verblindeter radiologischer Auswertung als primärem Ziel bei 632 erwachsenen Patienten mit aktiver rheumatoider Arthritis (vorhanden seit
In dieser Studie wurde der strukturelle Gelenkschaden durch Röntgenverfahren bewertet und als Veränderung des Total Sharp Score (TSS) ausgedrückt, der die Erosionsrate und die Gelenkraumreduktionsrate (JSN) umfasst.
Röntgenbilder von Händen/Handgelenken und Füßen wurden zu Studienbeginn und nach 6, 12 und 24 Monaten abgelesen Die 10 mg Enbrel-Dosis hatte eine durchweg geringere Wirkung auf strukturelle Schäden als die 25 mg-Dosis 25 mg Enbrel hatte eine signifikant größere Wirkung auf die Erosionsrate nach 12 und 24 Monaten im Vergleich zu Methotrexat. Die Unterschiede in TSS und JSN waren zwischen Methotrexat und Enbrel 25 mg statistisch nicht signifikant.
In einer weiteren randomisierten, doppelblinden, aktiv kontrollierten klinischen Studie wurden klinische Wirksamkeit, Sicherheit und röntgenologische Progression bei Patienten mit rheumatoider Arthritis, die mit Enbrel allein (25 mg zweimal wöchentlich) behandelt wurden, mit Methotrexat allein (von 7, 5 bis 20 mg pro Woche) , mittlere Dosis 20 mg) und mit der gleichzeitig begonnenen Kombination von Enbrel und Methotrexat wurden bei 682 erwachsenen Patienten mit aktiver rheumatoider Arthritis zwischen 6 Monaten und 20 Jahren (im Mittel 5 Jahre) verglichen, die auf at . unzureichend angesprochen hatten mindestens ein krankheitsmodifizierendes Antirheumatikum (DMARD) außer Methotrexat.
Patienten in der Enbrel in Kombination mit Methotrexat-Therapiegruppe wiesen ein signifikant höheres ACR 20-, ACR 50-, ACR 70-Ansprechen und eine Verbesserung der DAS- und HAQ-Werte sowohl nach 24 als auch nach 52 Wochen im Vergleich zu Patienten in beiden Gruppen auf, die in Monotherapie behandelt wurden. (Die Ergebnisse sind in der Tabelle unten gezeigt). Signifikante Vorteile wurden auch nach 24 Monaten für Enbrel in Kombination mit Methotrexat im Vergleich zu Enbrel allein und Methotrexat allein beobachtet.
Die röntgenologische Progression nach 12 Monaten war in der Enbrel-Gruppe signifikant geringer als in der Methotrexat-Gruppe, während die Kombination der beiden signifikant besser war als die beiden Monotherapien hinsichtlich der Verlangsamung der radiologischen Progression.
Signifikante Vorteile wurden auch nach 24 Monaten für Enbrel in Kombination mit Methotrexat im Vergleich zu Enbrel allein und Methotrexat allein beobachtet. Ebenso wurden nach 24 Monaten signifikante Vorteile für Enbrel allein gegenüber Methotrexat allein beobachtet.
In einer Analyse, bei der alle Patienten, die die Studie aus irgendeinem Grund abgebrochen hatten, eine radiologische Progression aufwiesen, war der Prozentsatz der Patienten ohne Progression (TSS-Änderung ≤ 0,5) nach 24 Monaten in der Gruppe, die mit Enbrel in Kombination mit Methotrexat behandelt wurde, höher gegenüber der Gruppe, die mit Enbrel allein und mit Methotrexat allein behandelt wurde (62 %, 50 % bzw. 36 %; p
Die Sicherheit und Wirksamkeit von Enbrel 50 mg (zwei Injektionen zu 25 mg s mg einmal wöchentlich und 153 Patienten erhielten Enbrel zweimal wöchentlich 25 mg. Das Sicherheits- und Wirksamkeitsprofil der beiden Enbrel-Behandlungsschemata war in Woche 8 hinsichtlich ihrer Auswirkungen auf die Anzeichen und Symptome der rheumatoiden Arthritis vergleichbar; Daten in Woche 16 zeigten keine Vergleichbarkeit (Nicht-Unterlegenheit) zwischen den beiden Behandlungsregimen.
Es wurde gezeigt, dass eine einzelne 50 mg/ml-Injektion von Enbrel mit zwei gleichzeitigen 25 mg/ml-Injektionen bioäquivalent ist.
Erwachsene Patienten mit Psoriasis-Arthritis
Die Wirksamkeit von Enbrel wurde in einer randomisierten, doppelblinden, placebokontrollierten Studie mit 205 Patienten mit Psoriasis-Arthritis im Alter von 18 bis 70 Jahren untersucht und litten an aktiver Psoriasis-Arthritis (≥ 3 geschwollene Gelenke und ≥ 3 schmerzende Gelenke) in at mindestens eine der folgenden Formen: Beteiligung der distalen Interphalangealgelenke (DIP); polyartikuläre Arthritis (Fehlen von rheumatoiden Knötchen und Vorhandensein von Psoriasis); verstümmelnde Arthritis; asymmetrische Psoriasis-Athritis; oder Spodylitis-ähnliche Ankylose. Die Patienten hatten auch Plaque-Psoriasis mit einem Läsionsindex von ≥ 2 cm Durchmesser. Die Patienten waren zuvor mit NSAR (86 %), DMARDs (80 %) und Kortikosteroiden (24 %) behandelt worden. Patienten mit Methotrexat-Therapie (stabil für ≥ 2 Monate) konnten mit einer stabilen Methotrexat-Dosis von ≤ 25 mg/Woche fortfahren. Dosen von 25 mg Enbrel (basierend auf Dosisfindungsstudien bei Patienten mit rheumatoider Arthritis) oder Placebo wurden 6 Monate lang zweimal wöchentlich subkutan verabreicht. Am Ende der Doppelblindstudie konnten die Patienten an einer langfristigen offenen Verlängerungsstudie mit einer Gesamtdauer von bis zu 2 Jahren teilnehmen.
Das klinische Ansprechen wurde als Prozentsatz der Patienten, die ein Ansprechen der ACR 20, 50 und 70 erreichten, und als Prozentsatz der Verbesserung gemäß den Ansprechkriterien für Psoriasis-Arthritis (PsARC) ausgedrückt.Die Ergebnisse sind in der folgenden Tabelle aufgeführt.
Bei Patienten mit Psoriasis-Arthritis, die Enbrel erhielten, war das klinische Ansprechen beim ersten Besuch (4 Wochen) offensichtlich und blieb während der 6-monatigen Therapie erhalten. Enbrel war bei allen Krankheitsaktivitätsindizes signifikant besser als Placebo (p
Die Behandlung mit Enbrel führte zu einer Verbesserung der körperlichen Funktion während der Doppelblindphase, und dieser Vorteil wurde während einer Langzeitexposition von bis zu 2 Jahren aufrechterhalten.
Aufgrund der geringen Zahl der untersuchten Patienten gibt es keine ausreichenden Belege für die Wirksamkeit von Enbrel bei Patienten mit ankylosierenden Spondylitis-ähnlichen Arthropathien und verstümmelnder Psoriasis-Arthritis.
Es wurden keine Studien bei Patienten mit Psoriasis-Arthritis in einer Dosierung von 50 mg einmal wöchentlich durchgeführt. Der Nachweis der Wirksamkeit einer einmal wöchentlichen Dosierung bei dieser Patientenpopulation beruhte auf Daten aus Studien an Patienten mit ankylosierender Spondylitis.
Erwachsene Patienten mit ankylosierender Spondylitis
Die Wirksamkeit von Enbrel bei Spondylitis ankylosans wurde in 3 randomisierten, doppelblinden Studien untersucht, in denen die Anwendung von Enbrel 25 mg zweimal wöchentlich mit Placebo verglichen wurde. Insgesamt wurden 401 Patienten eingeschlossen, von denen 203 mit Enbrel behandelt wurden in diese Studien (n = 277) schlossen Patienten im Alter von 18 bis 70 Jahren ein, die eine aktive Spondylitis ankylosans hatten, definiert als ein Score von ≥ 30 auf einer visuellen Analogskala (VAS) für die mittlere Dauer und Intensität der Morgensteifigkeit plus einen VAS-Score ≥30 für mindestens 2 der folgenden 3 Parameter: Gesamtbeurteilung des Patienten; Mittelwert der VAS-Werte für nächtliche und lumbosakrale Schmerzen insgesamt; durchschnittlich 10 Fragen aus dem "Bath Ankylosing Spondylits Functional Index" (BASFI). Patienten, die DMARDs, NSAIDs oder Kortikosteroide erhielten, konnten diese mit stabilen Dosen fortsetzen. Patienten mit kompletter Ankylose der Wirbelsäule wurden nicht in die Studie eingeschlossen. Dosen von 25 mg Enbrel (basierend auf Studien zur Bestimmung der Dosis bei Patienten mit rheumatoider Arthritis) oder Placebo wurden 6 Monate lang zweimal wöchentlich bei 138 Patienten subkutan verabreicht.
Als primäres Maß für die Wirksamkeit (ASAS 20) wurde eine Verbesserung von ≥20 % in mindestens 3 der 4 Domänen der „Beurteilung bei Spondylitis ankylosans“ (ASAS) (Gesamtbeurteilung des Patienten, lumbosakraler Schmerz, BASFI und Entzündung) und keine Verschlechterung festgestellt in der vorherigen Domäne. Die ASAS 50- und ASAS 70-Antworten basierten auf denselben Kriterien mit einer Verbesserung von 50 % bzw. 70 %.
Im Vergleich zu Placebo führte die Behandlung mit Enbrel bereits 2 Wochen nach Therapiebeginn zu signifikanten Verbesserungen bei ASAS 20, ASAS 50 und ASAS 70.
Bei Patienten mit ankylosierender Spondylitis, die Enbrel erhielten, war ein klinisches Ansprechen ab dem ersten Besuch (2 Wochen) offensichtlich und wurde über 6 Monate der Therapie aufrechterhalten.
Das Ansprechen war bei Patienten ähnlich, die zu Studienbeginn Begleitmedikationen einnahmen oder nicht.
Ähnliche Ergebnisse wurden in zwei kleineren Studien zur ankylosierenden Spondylitis erzielt.
In einer vierten, doppelblinden, placebokontrollierten Studie mit 356 Patienten mit aktiver ankylosierender Spondylitis wurden die Sicherheit und Wirksamkeit von Enbrel 50 mg (zwei subkutane Injektionen zu 25 mg) einmal wöchentlich im Vergleich zu Enbrel 25 untersucht Sicherheits- und Wirksamkeitsprofile von 50 mg einmal wöchentlich und 25 mg zweimal wöchentlich waren ähnlich.
Erwachsene Patienten mit Plaque-Psoriasis
Die Anwendung von Enbrel bei Patienten wird wie in Abschnitt 4.1 beschrieben empfohlen.In der untersuchten Population wurden Patienten, die "nicht auf reagierten", definiert durch unzureichendes Ansprechen (PASI PGA weniger als gut) oder Krankheitsverschlechterung während der Behandlung, die ausreichend lange ausreichend behandelt worden waren, um das Ansprechen auf at . zu bewerten mindestens jede der drei wichtigsten systemischen Therapien nach Verfügbarkeit.
Die Wirksamkeit von Enbrel gegen andere systemische Therapien bei Patienten mit mittelschwerer bis schwerer Psoriasis (die auf andere systemische Therapien ansprechen) wurde nicht in direkten Vergleichsstudien zwischen Enbrel und anderen systemischen Therapien untersucht, sondern die Sicherheit und Wirksamkeit von Enbrel wurden in vier randomisierten Studien untersucht , doppelblinde, placebokontrollierte Studien.
Der primäre Wirksamkeitsendpunkt in allen vier Studien war der Anteil der Patienten in jeder Behandlungsgruppe, die in Woche 12 einen PASI 75 erreichten (d. h. eine Verbesserung des Psoriasis Area Scores und des Schweregrads [PASI] um mindestens 75 % gegenüber dem Ausgangswert).
Studie 1 war eine Phase-2-Studie bei Patienten im Alter von ≥ 18 Jahren mit aktiver, aber klinisch stabiler Plaque-Psoriasis, die eine „Körperoberfläche von ≥ 10 % betraf. Einhundertzwölf Patienten wurden randomisiert, um eine Dosis von 25 mg zu erhalten. Enbrel (n = 57) oder Placebo (n = 55) zweimal wöchentlich für 24 Wochen.
Studie 2 bewertete 652 Patienten mit chronischer Plaque-Psoriasis unter Verwendung der gleichen Einschlusskriterien wie Studie 1 mit einem zusätzlichen Psoriasis Area and Severity Index (PASI) von mindestens 10 beim Screening. Enbrel wurde in einer Dosierung von 25 mg einmal wöchentlich, 25 mg zweimal wöchentlich oder 50 mg zweimal wöchentlich für 6 aufeinanderfolgende Monate Während der ersten 12 Wochen der doppelblinden Behandlungsphase erhielten die Patienten Placebo oder eine der drei oben genannten Stärken von Enbrel. Nach 12 Behandlungswochen erhielten die Patienten das Placebo Gruppe begann die Behandlung mit verblindetem Enbrel (25 mg zweimal wöchentlich), die Patienten in den aktiven Behandlungsgruppen setzten die Behandlung bis Woche 24 mit der ursprünglichen Dosierung fort.
Studie 3 untersuchte 583 Patienten und hatte die gleichen Einschlusskriterien wie Studie 2. Die Patienten in dieser Studie erhielten 12 Wochen lang zweimal wöchentlich 25 mg oder 50 mg Enbrel oder Placebo, danach erhielten alle Patienten zweimal 25 mg Enbrel unverblindet a Woche für weitere 24 Wochen.
Studie 4 untersuchte 142 Patienten und hatte ähnliche Einschlusskriterien wie Studie 2 und 3. Die Patienten in dieser Studie erhielten 12 Wochen lang einmal wöchentlich entweder 50 mg Enbrel oder Placebo, danach erhielten alle Patienten einmal wöchentlich 50 mg Enbrel unverblindet für eine 12 Wochen zusätzlich.
In Studie 1 hatte die Enbrel-Gruppe einen signifikant höheren Anteil an Patienten mit einem Pasi-75-Ansprechen in Woche 12 (30 %) als die Placebo-Gruppe (2 %) (p
Bei Plaque-Psoriasis-Patienten, die Enbrel erhielten, waren zum Zeitpunkt des ersten Besuchs (2 Wochen) signifikante Reaktionen im Vergleich zu Placebo erkennbar und wurden für 24 Wochen der Therapie beibehalten.
Studie 2 umfasste auch eine Behandlungsabbruchphase, in der Patienten, die in Woche 24 eine PASI-Verbesserung von mindestens 50 % erreichten, die Behandlung abbrachen.
Während der Absetzphase wurden die Patienten auf das Auftreten von „Rebound“-Ereignissen (PASI ≥ 150 % des Ausgangswerts) und die Zeit bis zum Rückfall (definiert als Verlust von mindestens der Hälfte der zwischen Ausgangswert und Woche 24 erreichten Verbesserung) beobachtet. Während der Absetzzeit traten die Psoriasis-Symptome allmählich mit einer medianen Zeit bis zum Rückfall von 3 Monaten wieder auf. Es wurden keine Rebound-Rezidive und keine schwerwiegenden Nebenwirkungen im Zusammenhang mit Psoriasis beobachtet. Es gab einige Belege für den Nutzen einer neuen Behandlung mit Enbrel bei Patienten, die anfänglich auf die Behandlung ansprachen.
In Studie 3 behielt die Mehrheit der Patienten (77%), die anfänglich auf 50 mg zweimal wöchentlich randomisiert wurden und die in Woche 12 eine reduzierte Dosis von 25 mg Enbrel zweimal wöchentlich erhielten, ein Ansprechen bei. PASI 75 bis Woche 36. Für Patienten, die 25 mg zweimal wöchentlich während der gesamten Studie, das Ansprechen auf PASI 75 verbesserte sich zwischen den Wochen 12 und 36 weiter.
In Studie 4 hatte die Enbrel-Gruppe einen höheren Anteil an Patienten mit PASI 75 in Woche 12 (38 %) als die Placebo-Gruppe (2 %) (p
In einer offenen Langzeitstudie (bis zu 34 Monate), in der Enbrel ohne Unterbrechung verabreicht wurde, blieb das klinische Ansprechen erhalten und die Sicherheit war mit der in den Kurzzeitstudien vergleichbar.
Eine Analyse der Daten aus klinischen Studien ergab zu Studienbeginn keine Krankheitsmerkmale, die dem Kliniker bei der Auswahl der am besten geeigneten Dosierungsoption (intermittierend oder kontinuierlich) helfen könnten. Folglich muss die Wahl der kontinuierlichen oder intermittierenden Therapie auf der Beurteilung des Arztes und den individuellen Bedürfnissen des Patienten beruhen.
Anti-Enbrel-Antikörper
Im Serum einiger Patienten, die mit Etanercept behandelt wurden, wurden Antikörper gegen Etanercept nachgewiesen. Diese Antikörper waren alle nicht neutralisierend und im Allgemeinen vorübergehend. Es scheint keine Korrelation zwischen der Antikörperentwicklung und dem klinischen Ansprechen oder unerwünschten Ereignissen zu geben.
In klinischen Studien mit Patienten, die bis zu 12 Monate lang mit zugelassenen Etanercept-Dosen behandelt wurden, betrugen die kumulativen Mengen an Anti-Etanercept-Antikörpern ungefähr 6 % bei Patienten mit rheumatoider Arthritis, 7,5 % bei Patienten mit Psoriasis-Arthritis, 2 % bei Patienten mit alkylierender Spondylitis, 7 % bei Patienten mit Psoriasis, 9,7 % bei Patienten mit Psoriasis bei Kindern und 3 % bei Patienten mit juveniler idiopathischer Arthritis.
Der Anteil der Patienten, die in Langzeitstudien (bis zu 3,5 Jahre) Antikörper gegen Etanercept entwickelten, nimmt wie erwartet mit der Zeit zu. Aufgrund ihrer vorübergehenden Natur lag die Inzidenz von Antikörpern, die an jedem Bewertungspunkt nachgewiesen wurden, jedoch bei Patienten mit rheumatoider Arthritis und bei Patienten mit Psoriasis im Allgemeinen unter 7 %.
In einer Langzeitstudie zu Psoriasis, in der die Patienten 96 Wochen lang zweimal wöchentlich 50 mg erhielten, betrug die Inzidenz der beobachteten Antikörper an jedem Bewertungspunkt etwa 9 %.
Pädiatrische Patienten mit Plaque-Psoriasis
Die Wirksamkeit von Enbrel wurde in einer randomisierten, doppelblinden, placebokontrollierten Studie an 211 pädiatrischen Patienten im Alter von 4 bis 17 Jahren mit mittelschwerer bis schwerer Plaque-Psoriasis (definiert durch einen sPGA-Score ≥ 3 mit 10 % oder mehr BSA, und PASI ≥ 12) Geeignete Patienten hatten in der Vorgeschichte eine Behandlung mit Phototherapie oder systemischer Therapie oder wurden durch topische Therapie unzureichend kontrolliert.
Die Patienten erhielten 12 Wochen lang einmal wöchentlich Enbrel 0,8 mg / kg (bis zu 50 mg) oder Placebo. In Woche 12 zeigten in der randomisierten Enbrel-Gruppe mehr Patienten ein positives Ansprechen auf die Wirksamkeit (d. h. PASI 75) als in der randomisierten Placebo-Gruppe.
Nach dem 12-wöchigen doppelblinden Behandlungszeitraum erhielten alle Patienten für weitere 24 Wochen einmal wöchentlich Enbrel 0,8 mg/kg (bis zu 50 mg). Die während der Open-Label-Phase beobachteten Reaktionen waren ähnlich denen, die in der doppelblinden Phase beobachtet wurden.
Während einer randomisierten Absetzphase war die Zahl der Patienten, die einen Krankheitsrezidiv (Verlust des Ansprechens PASI 75) hatten, in der Patientengruppe, die erneut auf Placebo randomisiert wurde, signifikant größer als in der Gruppe der Patienten, die erneut auf Enbrel randomisiert wurde. Bei fortgesetzter Therapie wurde das Ansprechen bis zu 48 Wochen aufrechterhalten.
Die langfristige Sicherheit und Wirksamkeit von Enbrel 0,8 mg/kg (bis zu maximal 50 mg) einmal wöchentlich wurde in einer offenen Verlängerungsstudie mit 181 pädiatrischen Patienten mit Plaque-Psoriasis durch Verabreichung des hergestellten Arzneimittels über einen Zeitraum von bis zu 2 Jahren danach untersucht die oben genannten 48 Wochen Die Langzeiterfahrungen mit Enbrel waren im Allgemeinen mit denen der ursprünglichen 48-wöchigen Studie vergleichbar, und es traten keine neuen Sicherheitsbedenken auf.
05.2 Pharmakokinetische Eigenschaften
Die Serumwerte von Etanercept wurden mit dem Enzyme-Linked Immunosorbent Assay (ELISA)-Verfahren bewertet, das sowohl Abbauprodukte, die mit dem ELISA reagieren, als auch die Muttersubstanz nachweisen kann.
Etanercept wird langsam von der subkutanen Injektionsstelle resorbiert und erreicht die maximale Konzentration etwa 48 Stunden nach einer Einzeldosis. Die absolute Bioverfügbarkeit beträgt 76 %. Bei zwei wöchentlichen Dosen sind die Steady-State-Konzentrationen voraussichtlich etwa doppelt so hoch wie nach Einzeldosen Nach einer subkutanen Einzeldosis von 25 mg Enbrel betrug die bei gesunden Probanden beobachtete mittlere maximale Serumkonzentration 1,65 ± 0,66 µg/ml und die Fläche unter der Kurve 235 ± 96,6 µg • Stunde/ml. Die Dosisproportionalität wurde nicht formell beurteilt, aber es gibt keine klare Sättigung der Clearance über den gesamten Dosisbereich.
Zur Beschreibung der Konzentrations-Zeit-Kurve von Etanercept ist eine biexponentielle Kurve erforderlich. Das zentrale Verteilungsvolumen von Etanercept beträgt 7,6 Liter, während das Verteilungsvolumen im Steady-State 10,4 Liter beträgt. Etanercept wird langsam aus dem Körper ausgeschieden. Es hat eine lange Halbwertszeit von ungefähr 70 Stunden. Die Clearance beträgt ungefähr 0,066 Liter / Stunde bei Patienten mit rheumatoider Arthritis, etwas niedriger als der bei gesunden Freiwilligen beobachtete Wert von 0,11 Liter / Stunde. Darüber hinaus ist die Pharmakokinetik von Enbrel bei Patienten mit rheumatoider Arthritis, ankylosierender Spondylitis und Plaque-Psoriasis ähnlich.
Die mittleren Serumkonzentrationsprofile im Steady State, d. h. Cmax (2,4 mg/l vs 2,6 mg/l), Cmin (1,2 mg/l vs 1,4 mg/l) und partielle AUC (297 mgh/l vs 316 mgh/l) waren vergleichbar bei Patienten mit rheumatoider Arthritis, die mit Etanercept 50 mg einmal wöchentlich (n = 21) bzw. mit Etanercept 25 mg zweimal wöchentlich (n = 16) behandelt wurden Freiwilligen, Etanercept als Einzeldosis-Injektion von 50 mg / ml verabreicht, war bioäquivalent zu zwei gleichzeitigen Injektionen von 25 mg / ml.
In einer populationspharmakokinetischen Analyse bei Patienten mit ankylosierender Spondylitis betrugen die Steady-State-AUC von Etanercept 466 µg * h/ml bzw. 474 µg * h/ml für Enbrel 50 mg einmal wöchentlich (N = 154) und 25 mg zweimal wöchentlich (N = 148) bzw.
Obwohl nach Verabreichung von radioaktiv markiertem Etanercept bei Patienten und Freiwilligen Radioaktivität im Urin ausgeschieden wird, wurde bei Patienten mit akuter Nieren- oder Leberinsuffizienz kein Anstieg der Etanercept-Konzentration beobachtet. Das Vorliegen einer Nieren- oder Leberinsuffizienz sollte keine Dosisanpassung erfordern. Es gibt keinen offensichtlichen Unterschied in der Pharmakokinetik zwischen Männern und Frauen.
Methotrexat verändert die Pharmakokinetik von Etanercept nicht Die Wirkung von Enbrel auf die Humanpharmakokinetik von Methotrexat wurde nicht untersucht.
Besondere Bevölkerungsgruppen
Ältere Patienten
Der Einfluss des höheren Alters wurde durch eine „pharmakokinetische Analyse der Plasmakonzentrationen von Etanercept in dieser Population“ untersucht. Die bei Patienten im Alter von 65 bis 87 Jahren beurteilten Clearance und Volumen waren ähnlich wie bei Patienten unter 65 Jahren.
Kinder und Jugendliche
Pädiatrische Patienten mit Plaque-Psoriasis
Pädiatrische Patienten mit Plaque-Psoriasis (im Alter von 4 bis 17 Jahren) erhielten 48 Wochen lang einmal wöchentlich 0,8 mg Etanercept pro Kilo (bis zu einer Höchstdosis von 50 mg pro Woche). Die mittleren Steady-State-Serumkonzentrationen lagen in den Wochen 12, 24 und 48 zwischen 1,6 und 2,1 µg/ml.
Diese mittleren Serumkonzentrationen bei Patienten mit pädiatrischer Plaque-Psoriasis ähneln denen, die bei Patienten mit idiopathischer juveniler Arthritis beobachtet wurden (unter Behandlung mit 0,4 mg Etanercept pro Kilogramm zweimal wöchentlich bis zu einer Höchstdosis von 50 mg pro Woche).
Diese mittleren Konzentrationen ähneln denen, die bei erwachsenen Patienten mit Plaque-Psoriasis beobachtet wurden, die einmal wöchentlich mit Etanercept 25 mg behandelt wurden.
05.3 Präklinische Sicherheitsdaten
In toxikologischen Studien mit Enbrel wurde keine dosislimitierende oder Zielorgantoxizität beobachtet. Enbrel hat sich in einer Reihe von Studien als nicht genotoxisch erwiesen in vitro und in vivo.
Aufgrund des Auftretens neutralisierender Antikörper bei Nagetieren wurden mit Enbrel keine Karzinogenitätsstudien und keine Standardbewertung der Fertilität und postnatalen Toxizität durchgeführt.
Enbrel verursachte bei Mäusen oder Ratten nach einer subkutanen Einzeldosis von 2000 mg / kg oder einer intravenösen Einzeldosis von 1000 mg / kg keine nachweisbare Mortalität oder Toxizitätszeichen. Enbrel verursachte bei Cynomolgus-Affen nach subkutaner Verabreichung zweimal wöchentlich über 4 oder 26 aufeinanderfolgende Wochen in einer Dosis (15 mg/kg) keine dosislimitierende oder Zielorgan-Toxizität, was zu Serum-Wirkstoffkonzentrationen basierend auf der AUC führte, die mehr als 27-mal höher waren als bei Männern in der empfohlenen Dosis von 25 mg.
06.0 PHARMAZEUTISCHE INFORMATIONEN
06.1 Hilfsstoffe
Saccharose
Natriumchlorid
L-Arginin-Hydrochlorid
Monobasisches Natriumphosphat-Dihydrat,
Dinatriumphosphat-Dihydrat
Wasser für Injektionszwecke
06.2 Inkompatibilität
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
06.3 Gültigkeitsdauer
30 Monate
06.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (zwischen 2 ° C und 8 ° C).
Nicht einfrieren.
Enbrel kann bei einer maximalen Temperatur von 25 ° C bis zu 4 Wochen lang nur einmal gelagert werden; nach dieser Zeit kann es nicht wieder in den Kühlschrank gestellt werden. Wenn Enbrel nicht innerhalb von 4 Wochen außerhalb des Kühlschranks verwendet wird, sollte es entsorgt werden.
Bewahren Sie die Fertigspritzen im Umkarton auf, um sie vor Licht zu schützen.
06.5 Art der unmittelbaren Verpackung und Inhalt des Packstücks
Klarglasspritze (Typ-I-Glas) mit Edelstahlnadel, Gumminadelabdeckung und Kunststoffkolben.
Die Packungen enthalten 2, 4 oder 12 Enbrel-Fertigspritzen mit 4, 8 oder 24 Alkoholtupfern. Die Nadelschutzhülle enthält getrockneten Naturkautschuk (Latex) (siehe Abschnitt 4.4)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
06.6 Gebrauchs- und Handhabungshinweise
Gebrauchs- und Handhabungshinweise
Die Enbrel-Einzeldosis-Fertigspritze muss vor der Injektion Raumtemperatur erreicht haben (ungefähr 15 bis 30 Minuten).Die Nadelschutzhülle sollte nicht entfernt werden, bis die Fertigspritze Raumtemperatur erreicht hat. Die Lösung sollte klar oder farblos oder blassgelb und praktisch frei von sichtbaren Partikeln sein.
Detaillierte Anweisungen zur Anwendung finden Sie in der Packungsbeilage, Abschnitt 7, „Anleitung zur Vorbereitung und Verabreichung einer „Enbrel-Injektion“.
Nicht verwendete Arzneimittel und Abfälle aus diesem Arzneimittel müssen gemäß den örtlichen Vorschriften entsorgt werden.
07.0 INHABER DER MARKETING-ERLAUBNIS
Pfizer Limited
Ramsgate-Straße
Sandwich
Kent CT13 9NJ
Vereinigtes Königreich
08.0 NUMMER DER MARKETING-ERLAUBNIS
EU / 1/99/126/016
034675138
EU / 1/99/126/017
034675140
EU / 1/99/126/018
034675153
09.0 DATUM DER ERSTEN GENEHMIGUNG ODER ERNEUERUNG DER GENEHMIGUNG
Datum der Erstzulassung: 3. Februar 2000
Datum der letzten Verlängerung: 3. Februar 2010
10.0 DATUM DER ÜBERARBEITUNG DES TEXTs
September 2011