Für die Toxikodynamik werden im Guten wie im Schlechten die Konzepte der Pharmakodynamik aufgegriffen. Die Konzepte der Wechselwirkung mit einem Rezeptor auf unspezifische und spezifische Weise, Substrat-(toxische)-Rezeptor-Wechselwirkungen, die Affinität des Giftigen zum Rezeptor, die Potenz und schließlich der Antagonismus müssen bekannt sein. Diese Konzepte werden nicht aufgegriffen, da sie dieselben sind, die für das Medikament veranschaulicht wurden; wir werden jedoch auf einige typische Wirkmechanismen von toxischen Substanzen im Detail eingehen.
Das Gift wirkt wie das Medikament mit dem Zielmolekül, was der erste Untersuchungspunkt sein wird.
WAS IST DAS ZIEL DES TOXIKS? Das Ziel des Gifts ist die Zelle, die aus Proteinen, Lipiden, Nukleinsäuren und anderen Bestandteilen besteht.
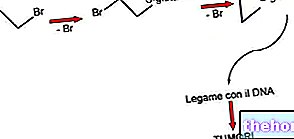
Der zweite Untersuchungspunkt ist die Art der Verbindung zwischen dem Giftstoff und der Zielzelle, ein wichtiger Faktor für die schwere Wirkung des Giftstoffs, der bekanntlich reversibel und irreversibel sein kann.
Wenn das Gift reversibel gebunden ist, kann es sich ablösen und die Wirkung ist weniger schwerwiegend als wenn es mit einer kovalenten Bindung an das Ziel bindet, also irreversibel.

Der dritte Untersuchungspunkt besteht in den Folgen der Interaktion zwischen der toxischen und der Zielzelle.
Was modifiziert das Gift, indem es an ein Zielmolekül bindet?
Es kann eine Änderung der Energieproduktion geben, sodass die Zelle kein ATP produziert und dem Tod entgegenwirkt; es kann zu einer Veränderung der Homöostase von intrazellulärem Calcium, einem der wichtigsten sekundären Botenstoffe, kommen oder schließlich zu einer Veränderung der Plasmamembran.
Dies sind alles Beispiele für zelluläre Funktionen, die durch das Gift bei der Bindung an die Zielstelle verändert werden.
DIE ZIELMOLEKÜLE
Wie bereits erwähnt, besteht die Zelle aus Proteinen, Lipiden, Nukleinsäuren und anderen Komponenten.
Die möglichen Zielmoleküle sind daher:
- PROTEINE (Membran, Enzyme ...);
- LIPIDE (Membranphospholipide);
- GRUPPEN -SH (Zytoskelettproteine);
- NUKLEINSÄUREN (wird in einem Artikel über Karzinogenese und DNA-Schäden erläutert).
1) PROTEINZIELE
Hier sind einige Beispiele für Protein-Targets. Im ersten Beispiel betrachten wir ein "Hämoprotein, das Hämoglobin ist" und ein sehr ähnliches Gift, das Kohlenmonoxid (CO) ist. Kohlenmonoxid, das dem Sauerstoff 250-mal ähnlicher ist, bindet an die -EME-Gruppe des Hämoglobins und verhindert so den Sauerstofftransport Die Gewebezellen sterben an ANÄMISCHER HYPOXIE, weil sie nicht den für die Zellatmung notwendigen Sauerstoff erhalten.
Im zweiten Beispiel wird ein enzymatisches Proteinmolekül, die Cyt-C-Oxidase, und das verwandte toxische Cyanid betrachtet. Cyt-C-Oxidase ist ein Enzym, das zur Elektronentransportkette gehört. Die Zellatmung findet auf der Ebene des Mitochondriums statt und die Cyt-C-Oxidase nutzt Sauerstoff, um sicherzustellen, dass vier H + -Ionen aus dem Mitochondrium ausgestoßen werden; diese Ausscheidung von Wasserstoffionen bildet die für die Synthese von ATP notwendige Potentialdifferenz. Enzym wird durch Cyanid blockiert , Cyt-C-Oxidase verwendet keinen molekularen Sauerstoff mehr, der optimale Protonengradient bildet sich nicht außerhalb des Mitochondriums; folglich synthetisiert die Zelle kein ATP. Auch in diesem Fall gehen die Zellen dem Tod durch Hypoxie entgegen; wir sprechen insbesondere von CYTOTOXIC HYPOXIA.
Unter all den Protein-Targets finden wir die Rezeptoren, die in der allgemeinen Pharmakologie erklärt wurden. Die wichtigsten Toxine wie Nikotin und Strychnin können mit verschiedenen Rezeptoren interagieren.
2) LIPID-ZIELE
Die am stärksten von freien Radikalen betroffenen Lipide sind die der Membran. Das freie Radikal entsteht aus chemischer Sicht, weil zwischen zwei Atomen keine "Heterolyse" stattfindet, also keine zwei Ionen mit einer homogenen Ladung gebildet werden, sondern es findet eine "Homolyse" statt.
Die Homolyse zeichnet sich durch eine ungleichmäßige Verteilung der Ladungen aus.

Freie Radikale entstehen aus äußeren Stoffen (Xenobiotika), aber auch in unserem Organismus (Sauerstofffreie Radikale). Wir können daher sagen, dass sich sowohl von außen als auch von innen in unserem Organismus freie Radikale bilden können.
Wie entstehen diese Radikale?
Freie Sauerstoffradikale können sich bilden, wenn sich die Sauerstoffpartialspannung in der Zelle ändert, es also zu plötzlichen Änderungen des Sauerstoffdrucks kommt. Dieser plötzliche Sauerstoffmangel begünstigt die Bildung von Radikalspezies im ischämischen (Gehirn) oder Herzgewebe. Die radikalen Sauerstoffspezies stellen hauptsächlich das SUPEROXID-ANION und das OXIDRILE dar. Der Mangel an Antioxidantien (Vitamine A, C und E), die Zellalterung, Xenobiotika und schließlich die akuten und / oder chronischen Entzündungszustände sind alles Phänomene, die zu dem Bildung von freien Radikalen.

Auf diese möglichen Schäden kann die Zelle durch das Einsetzen von freien Sauerstoffradikalen reagieren, da sie über bestimmte Enzyme verfügt, die der Aktivität der Radikale entgegenwirken.

Weitere Artikel zum Thema "Toxikodynamik"
- Paracetamol und Lebernekrose
- Toxizität und Toxikologie
- Zielmoleküle toxischer Substanzen