Was ist TRISENOX?
TRISENOX ist ein Konzentrat zur Rekonstitution einer Infusionslösung mit Arsentrioxid (1 mg/ml) als Wirkstoff.
Wofür wird TRISENOX verwendet?
TRISENOX wird zur Behandlung von erwachsenen Patienten mit akuter Promyelozytärer Leukämie - LPA (Krebs der weißen Blutkörperchen) angewendet. Diese Krankheit wird durch eine genetische "Translokation" (einen Austausch von Genen zwischen zwei Chromosomen) verursacht. Die Mutation beeinträchtigt die Reproduktion der weißen Blutkörperchen, die Retinsäure (Vitamin A) nicht mehr verwerten können. APL-Patienten werden in der Regel mit Retinoiden (von Vitamin A abgeleitete Substanzen) behandelt. TRISENOX wird angewendet, wenn die Patienten auf die Behandlung nicht ansprachen mit Retinoiden und Krebsmedikamenten oder im Falle eines Rückfalls nach dieser Art von Behandlungen.
Das Arzneimittel ist nur auf ärztliche Verschreibung erhältlich.
Wie wird TRISENOX angewendet?
Die Behandlung mit TRISENOX sollte von einem Arzt überwacht werden, der Erfahrung in der Behandlung von Patienten mit akuter Leukämie hat. TRISENOX wird täglich verabreicht, bis Symptome der Wirksamkeit der Behandlung registriert werden (das Knochenmark enthält keine Leukämiezellen mehr) Wird diese Verbesserung nicht innerhalb von fünfzig Tagen nach Behandlungsbeginn beobachtet, sollte die Verabreichung ausgesetzt werden. Die erste Behandlung wird dann drei oder vier Wochen später konsolidiert, indem TRISENOX einmal täglich für fünf Tage verabreicht wird, gefolgt von zwei freien Tagen für fünf Wochen. TRISENOX wird als intravenöse Infusion (Tropfinfusion in eine Vene) mit einer Dosis von 0,15 mg pro Kilogramm Körpergewicht für jeden Patiententyp verabreicht. (Kinder, Erwachsene und ältere Menschen).
Wie wirkt TRISENOX?
Der Wirkstoff von TRISENOX, Arsentrioxid, ist ein seit vielen Jahren in der Medizin eingesetzter Wirkstoff, unter anderem zur Behandlung von Leukämie. Die Art und Weise, wie es auf diese Pathologie einwirkt, ist noch nicht vollständig verstanden.Es wird angenommen, dass diese Substanz die Produktion von DNA verhindert, die für das Wachstum von Leukämiezellen notwendig ist.
Wie wurde TRISENOX untersucht?
TRISENOX wurde in zwei klinischen Studien mit insgesamt 52 Patienten mit APL untersucht, die zuvor mit Anthrazyklin (einem Arzneimittel gegen Krebs) und mit einem Retinoid behandelt wurden. Die erste Studie hat
betroffen waren 12 Patienten, der zweite 40, und TRISENOX wurde in beiden nicht mit anderen Medikamenten verglichen. Der Hauptindikator für die Wirksamkeit in klinischen Studien war der Anteil der Patienten, die eine vollständige Remission ohne Krebszellen im Knochenmark und die Erholung der Thrombozyten- und weißen Blutkörperchenwerte zeigten.
Welchen Nutzen hat TRISENOX in den Studien gezeigt?
Betrachtet man die Ergebnisse der beiden gepoolten Studien, zeigten 45 (87%) der 52 Patienten eine vollständige Remission, die im Durchschnitt in 57 Tagen erreicht wurde.
Welches Risiko ist mit TRISENOX verbunden?
Sehr häufige Nebenwirkungen (beobachtet bei 1 bis 10 von 100 Patienten) sind Neutropenie (Mangel an weißen Blutkörperchen), Thrombozytopenie (Mangel an Blutplättchen), Hyperglykämie (erhöhter Blutzucker), Hypokaliämie (Mangel an Kalium im Blut), Parästhesie (Kribbeln und Stechen), Rippenfellschmerzen (Brustschmerzen), Dyspnoe (Atembeschwerden), Knochenschmerzen, Arthralgie (Gelenkschmerzen), Pyrexie (Fieber), Müdigkeit, verlängerte QT-Intervalle im Elektrokardiogramm (unregelmäßiger Herzschlag) und erhöhter Alaninaminotransferase und Aspartataminotransferase (Leberenzyme). Die vollständige Liste der von TRISENOX berichteten Nebenwirkungen finden Sie in der Packungsbeilage. TRISENOX darf nicht bei Patienten angewendet werden, die möglicherweise überempfindlich (allergisch) gegen Arsentrioxid oder einen der anderen Stoffe sind. Da Arsentrioxid das Herz schädigen kann , sollten Patienten, denen TRISENOX verabreicht wird, engmaschig überwacht und vor und während der Behandlung einem Elektrokardiogramm unterzogen werden.
Warum wurde TRISENOX zugelassen?
Der Ausschuss für Humanarzneimittel (CHMP) war der Ansicht, dass der Nutzen von TRISENOX die Risiken für die Induktion und Konsolidierung einer Remission bei erwachsenen Patienten mit rezidivierter/refraktärer akuter Promyelozytärer Leukämie (PLA), gekennzeichnet durch das Vorliegen einer Translokation t (15; 17 .), überwiegt ) und / oder das PML / RAR-alpha-Gen Die vorherige Behandlung muss Retinoide und Chemotherapie umfasst haben.
Der Ausschuss empfahl die Erteilung einer Genehmigung für das Inverkehrbringen von TRISENOX. TRISENOX wurde unter „außergewöhnlichen Umständen“ zugelassen. Dies bedeutet, dass es aufgrund der Seltenheit der mit diesem Arzneimittel behandelten Erkrankung nicht möglich war, vollständige Informationen über TRISENOX zu erhalten. Die Europäische Arzneimittel-Agentur (EMEA) überprüft jährlich neue verfügbare Informationen und aktualisiert diese Zusammenfassung bei Bedarf.
Welche Informationen stehen für TRISENOX noch aus?
Das Pharmaunternehmen TRISENOX wird Studien zur Anwendung von Trisenox bei Leberkrebspatienten und zur Anwendung des Arzneimittels zusammen mit Retinoiden und Chemotherapie bei der Behandlung von APL abschließen.
Weitere Informationen zu TRISENOX®
Für TRISENOX hat die Europäische Kommission am 5.3.2002 eine EU-weit gültige "Zulassung für das Inverkehrbringen" erteilt, die am 05.03.2007 verlängert wurde. Inhaber der Genehmigung für das Inverkehrbringen ist Cephalon Europe.
Für die vollständige Version des TRISENOX EPAR klicken Sie hier.
Letzte Aktualisierung dieser Zusammenfassung: Juli 2007
Die auf dieser Seite veröffentlichten Informationen zu TRISENOX - Arsentrioxid können veraltet oder unvollständig sein. Informationen zur korrekten Verwendung dieser Informationen finden Sie auf der Seite Haftungsausschluss und nützliche Informationen.





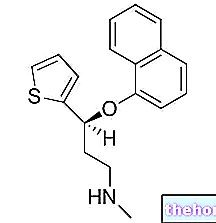








-cos-cause-sintomi-e-cura.jpg)


-cos-cause-sintomi-e-rimedi.jpg)